Introducción al intervencionismo neurovascular
1.-INTRODUCCIÓN
La terapia fibrinolítica se utiliza en pacientes con ictus basándose en el hecho de que la recanalización de la arteria ocluida reduce el daño cerebral antes de que se complete el infarto. Los primeros trabajos sobre trombolisis en el tratamiento de la oclusión de las arterias cerebrales fueron publicados en el año 1958 (Sussmann BJ; 1958) y aun, en el presente, continúa siendo un importante reto. El objetivo primordial del tratamiento intervencionista del ictus isquémico es lograr una recanalización precoz de las arterias ocluidas y restablecer la perfusión cerebral obteniendo la recuperación del tejido cerebral que no hubiese sufrido una lesión irreversible. Debido a la corta ventana terapéutica para el tratamiento del ictus isquémico agudo, es muy importante el tiempo utilizado para la evaluación y diagnóstico. (Marler JR; . 2000)
2.-EVOLUCIÓN EN EL CONCEPTO Y TRATAMIENTO DEL ICTUS
En los últimos años, el concepto de ictus ha sufrido un cambio radical. Si tradicionalmente se consideraba que el ictus no se podía prevenir, no podía ser tratado, ocurría solo en ancianos, no era tan importante como un infarto miocárdico (IM) y que la recuperación era inmediata o no la había, hoy en día se considera previsible, que requiere un tratamiento de emergencia y cualquier persona puede sufrir un ictus, que requiere la misma atención que un IM y que la recuperación del ictus continúa toda la vida pero que es crucial en los primeros tres meses. La mayoría de las agrupaciones que se ocupan del estudio y tratamiento del ictus isquémico, y que, en principio delimitan las pautas de la terapéutica en cada caso, coinciden en dos puntos importantes: el primero de ellos es que se considera como una verdadera emergencia médica, y el segundo es que todos estos pacientes deben ser tratados en una unidad de ictus, como fue establecido también en Helsingborg (Suecia) http://www.acponline.org/isim/stroke.pdf, donde entre el 8 y 10 de Noviembre de 1995 se realizó la primera reunión donde se evaluaron las ultimas pautas de tratamiento del ictus y se propusieron objetivos para el año 2005, y luego, en el año 2006 se realizó la segunda reunión de consenso organizada por la OMS, en colaboración con la Federación Europea de Sociedades Neurológicas, la Sociedad Internacional del Ictus y otras donde un grupo de expertos, representantes de los departamentos de salud de los distintos gobiernos, científicos, expertos en toma de decisiones, expertos en el manejo del Ictus y pacientes y asociaciones de pacientes, examinaron los datos actuales concernientes a los conocimientos disponibles sobre el manejo del Ictus, y llegaron a un acuerdo sobre un plan de acción para mejorar estos conocimientos y reforzar la calidad de la asistencia a los pacientes que han padecido un Ictus. Se abordaron cinco aspectos del manejo del Ictus: (Cuadro 1) (Ver Cuadro 1 jpg)
Actualmente existe un marcado interés a nivel mundial en el tratamiento endovascular del ictus isquémico cerebral. Si analizamos los datos estadísticos de esta enfermedad, vemos que constituye una de las más importantes causas de mortalidad (tercera causa), y también una importante causa de incapacidad (primera). En países desarrollados estas cifras pueden ser muy altas; se calcula que en USA afecta aproximadamente 500.000 personas al año. En España representa cerca de 150 a 200 casos por 100.000 habitantes por año, y entre un 4 a 8 % ocurre en individuos mayores de 65 años (Pérez-Sempere A; 1999) Los estudios epidemiológicos de Hankey y Warlow (Hankey GJ;1999) revelan que cada año, de una población de un millón de habitantes en un país desarrollado, 2400 paciente han recurrido a una unidad de cuidados por un primer ictus o un ictus recidivante, y 500 pacientes suplementarios presentan un ataque neurológico transitorio (AIT). Entre los 2400 pacientes que presentan ictus, 480 mueren en el término del primer mes (20%), y 1300 (55%) han muerto o dependen de un tercero en la actividad cotidiana al término del primer año.
Se han realizado numerosos estudios protocolizados referentes a la terapia de revascularización en el ictus isquémico, entre ellos podemos mencionar: SITS-MOST (Safe Implementation of Thrombolysis in Stroke-Monitoring Study).( Nils Wahlgren, Niaz Ahmed, Antoni Dávalos y col. 2007) MATS-I. NINDS (The National Institute of Neurological Disorders and Stroke rt- PA Stroke Study Group;1995) ECASSS I, ECASSII, (Werner Hacke;1995) PROACT I, PROACT II (Furla A, Higashida R;1999). Según los criterios actuales en el manejo del paciente con un ictus, estos deben de ingresar en Unidades Específicas de Ictus. En el año 1999, en una revisión sistemática realizada sobre 20 ensayos clínicos en el que se incluían casi 4.000 pacientes con ictus se encontró que aquellos pacientes que estaban en unidades específicas de ictus tenían mayor calidad de vida comparados con aquéllos que estaban ingresados en cualquier otra zona del hospital, y que se reducía el tiempo de estancia hospitalaria (Gubitz G;2000) Se ha demostrado que el manejo de estos pacientes ingresados en unidades específicas de ictus disminuye la mortalidad hasta en un 18%, y en un 25% en el ítem combinado de mortalidad y dependencia para las actividades de la vida diaria (Hacke W;2000) El tratamiento trombolítico intraarterial tiene muchas ventajas sobre la terapia intravenosa. El estudio PROACT II fue el primer estudio randomizado, controlado con placebo, para confirmar que el tratamiento intra-arterial (IA)es efectivo en el ictus isquémico agudo y que se puede realizar de forma segura. Este estudio demostró que los pacientes tratados con pro-urokinasa intra-arterial dentro de seis horas del inicio de los síntomas tenían un 15% más probabilidades de tener una mínima o ninguna discapacidad a los 3 meses con relación a los pacientes tratados solo con heparina. Por otra parte aunque hubo una tasa de 10% hemorragia sintomática en el grupo de tratamiento frente al 2% en el grupo placebo, no hubo una disminución significativa de la mortalidad en el grupo pro-urokinasa; sin embargo, las tasas de recanalización fueron significativamente mayores (66%) que los tratados por vía intravenosa con t-PA (33%). De hecho, el tratamiento intra-arterial para el ictus isquémico agudo se ha realizado durante años en muchos centros en todo el mundo, incluyendo el nuestro. Se ha reportado también el efecto benéfico del uso de la urokinasa o actividador tisular del plasminógeno (tPA) en series no controladas o randomizadas, y muchos neurointervencionistas han utilizado esta terapia, por lo que es práctica habitual en muchas comunidades.
En una revisión sobre la seguridad y la efectividad de la terapia intra-arterial, Rejane et al. (Rejane C;2002) revisaron 27 estudios con 852 pacientes tratados con Terapia trombolítica intra arterial (IA o combinado intravenoso (IV) / terapia trombolítica IA) para el accidente cerebrovascular isquémico agudo y 100 controles. Alrededor de cuarenta y un otros estudios se excluyeron debido al pequeño número de casos incluidos. La mayoría de los estudios eran series prospectivas o retrospectivas. Hubo tres estudios aleatorios (2 placebo-controlado y una comparación de IV / IA de la IA solo). Concluyen que la terapia intraarterial parece ser una opción eficaz en centros seleccionados con un personal adecuadamente entrenado.
3.-EFECTO DE LOSCAMBIOS VASCULARES EN EL ICTUS ISQUEMICO
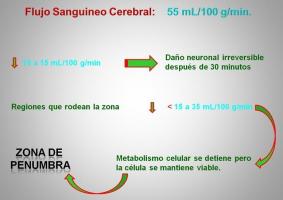
El flujo sanguíneo cerebral es de 55ml/100g/min. Cuando este flujo disminuye por efecto del trombo hasta niveles de 10 a 15 ml/100g/min, se produce un daño neuronal irreversible en un plazo aproximado de 30 minutos. En las zonas que rodean al area isquémica, podemos tener un flujo sanguíneo cerebral que varía entre 15 a 35 ml/100g/min; en este territorio, si bien el metabolismo celular se detiene, el tejido neuronal se mantiene viable. Esta zona es lo que se conoce como ZONA DE PENUMBRA (Cuadro 2) (Ver Cuadro 2 jpg)
Cuando se produce la disminución del flujo sanguíneo cerebral y se inicia la isquemia, al llegar el flujo a 25ml/100gr/min, se produce un aumento en la producción de lactato; esta disminución progresiva se traduce por una serie de cambios metabólicos, y al disminuir a 20ml/100gr/min existe una pérdida en la actividad eléctrica cerebral que evoluciona hacia una falla de la bomba Na/K, con una consecuente disminución del ATP, hasta llegar a la muerte neuronal. La zona de penumbra la ubicamos entre los 25 y 15 ml/100gr/min (Cuadro 3) (Ver Cuadro 3 jpg)
6-A. ANASTOMOSIS PIALES.
En general, la suplencia sanguínea colateral del cerebro después de la oclusión de un vaso se puede realizar a través de grandes vasos que se encuentran en el polígono de Willis o a través de conexiones entre los pequeños vasos piales que se encuentran en toda la superficie del cerebro. Las colaterales piales siempre existen anatómicamente como conexiones arteria-arteria entre diferentes territorios arteriales. Ellas se abren cuando la oclusión de un vaso principal origina una gran diferencia de perfusión a un territorio, movilizando la sangre a través de conexiones preexistentes para llenar el territorio afectado. La existencia de buenas colaterales influye en la mejoría clínica y el tamaño del infarto que se produce en el ictus. De hecho, la extensión de las colaterales se ha demostrado que tiene correlación con el volumen del infarto durante el ictus. Las colaterales piales se han definido de una manera subjetiva. Su conocimiento nos ayudará a predecir la evolución del paciente después de su tratamiento trombolítico.
La evaluación de la formación de colaterales piales se basó en la opacificación retrógrada
de los vasos dentro del territorio ocluido en la obtención de imágenes angiográficas tardías. (Gregory A. Christoforidis;2005). Se clasificaron las colaterales de la siguiente manera: (Cuadro 8) (Ver Cuadro 8 jpg)
1. Se asignó una puntuación de 1 si las colaterales reconstituían la porción distal del segmento de vaso ocluido (es decir, si había una oclusión del segmento M1, se reconstituía el segmento de M1 distal a la oclusión).
2. Una puntuación de 2 se le asignó si las colaterales reconstituían los vasos en la porción proximal del segmento adyacente al vaso ocluido (por ej. si había oclusión del segmento M1, las colaterales reconstituían el segmento proximal de M2).
3. Una puntuación de 3 fue asignado si las colaterales reconstituían los vasos en la porción distal del segmento adyacente al vaso ocluido. (ej. si había oclusión del segmento M1 con reconstitución distal del segmento M2).
4. Una puntuación de 4 fue asignado si las colaterales reconstituían
los vasos dos segmentos distales al vaso ocluido (es decir, si hay oclusión del segmento M1 con la reconstitución hasta las ramas del segmento M3)
5. Una puntuación de 5 se le asignó si había poco o nada de importante
en la revascularización del territorio del vaso ocluido.
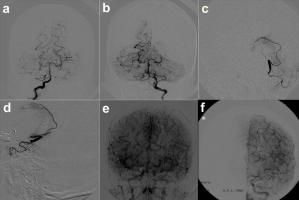
Es muy importante durante el proceso de arteriografía en el ictus, evaluar las colaterales piales, ya que ellas nos pueden dar un índice de la capacidad de recuperación del paciente con in ictus isquémico, teniendo por lo tanto, cierto valor pronóstico en la terapéutica y la evolución clínica. En la Figura 1 ( Ver Fig 1 jpg) se muestra un ejemplo de la recanalización a través de anastomosis en un caso de una paciente que tuvo una oclusión aguda durante un procedimiento endovascular para tratamiento de un aneurisma del tronco basilar. En a) podemos ver el estudio angiográfico inicial; en b), observamos la oclusión de la arteria cerebral posterior izquierda. c y d) corresponden al microcateterismo para realizar la fibrinólisis intra arterial, sin obtenerse la reapertura del vaso ocluido. En e y f) podemos ver la parenquimografía y angiografía de control, apreciándose la opacificación de la arteria cerebral posterior a contracorriente a través de anastomosis con la circulación anterior (territorio carotídeo).
De acuerdo a esto, podemos tener excelente suplencia colateral desde la circulación cerebral posterior que pueden suplir el lóbulo parietal posterior, la corteza sensitiva así como también el área de Wernicke. También tenemos que tomar en cuenta las arterias comunicantes anterior y posterior.
BIBLIOGRAFIA
• Accuracy of dynamic perfusion CT with deconvolution in detecting acute hemispheric stroke. AJNR Am J Neuroradiol. 2005;26:104 –112.
• Adams HP Jr, Brott TG, Furlan AJ, Gomez CR, Grotta J, Helgason CM, Kwiatkowski T, Lyden PD, Marler JR, Torner J, Feinberg W, Mayberg M, Thies W. Guidelines for thrombolytic therapy for acute stroke: a supplement to the guidelines for the management of patients with acute ischemic stroke: a statement for healthcare professionals from a Special Writing Group of the Stroke Council, American Heart Association. Circulation. 1996;94:1167–1174.
• Adams HP, Adams RJ, Brott T, Del Zoppo GJ, et al. Guidelines for the early management of patients Acta Neurol Colomb Vol. 22 No. 1 Marzo 2006 with ischemic stroke. A scientific statement from the stroke council of the American Stroke Association. Stroke 2003;34:1056-1083.
• Arnold M, Nedeltchev K, Schroth G, Baumgartner RW, Remonda L, Loher TJ, Stepper F, Sturzenegger M, Schuknecht B, Mattle HP. Clinical and radiological predictors of recanalisation and outcome of 40 patients with acute basilar artery occlusion treated with intra-arterial thrombolysis. J Neurol Neurosurg Psychiatry. 2004 Jun;75(6):857-62
• Becker KJ, Monsein LH, Ulatowski J, el al. Intraarterial thrombolysis in vertebrobasilar occlusion. AJNR Am J Neuroradiol 1996;17:255-262.
• Carlos Castaño, Laura Dorado, Cristina Guerrero, Monica Millán, Meritxell Gomis, Natalia Perez de la Ossa, Mar Castellanos, M. Rosa García, Sira Domenech and Antoni Dávalos. Mechanical Thrombectomy With the Solitaire AB Device in Large Artery Occlusions of the Anterior Circulation. A Pilot Study. Stroke published online Jun 10, 2010.
• Casasco A, Cuellar H, Gilo F, Guimaraens L, Thèron J. Vertebobasilar recanalization after 12 h of onset using baloon expandable stent and thrombolysis. Emerg Radiol. 2008 Jul;15(4):273-6).
• Furla A, Higashida R, Wechsler L, Gent M, Rowley H, Kase C, et al. The PROACT investigators. Intra-arterial Prourokinase for Acute Ischaemic Stroke. The PROACT II Study: A randomized Controlled Trial. JAMA 1999; 282: (21)2003-11.).
• Furlan A, Higashida R, Wechsler L, et al. Intra-arterial prourokinase for acute ischemic stroke: The PROACT II study—a randomized controlled trial. Prolyse in Acute Cerebral Thromboembolism. JAMA 1999;282:2003–11.
• Gobin YP, Starkman S, Duckwiler GR, Grobelny T, Kidwell CS, Jahan R, Pile-Spellman J, Segal A, Vinuela F, Saver JL. MERCI 1: a phase 1 study of Mechanical Embolus Removal in Cerebral Ischemia. Stroke. 2004 Dec;35(12):2848-54. Epub 2004 Oct 28
• Gonzalez RG, Schaefer PW, Buonanno FS, Schwamm LH, Budzik RF, Rordorf G, Wang B, Sorensen AG, Koroshetz WJ. Diffusion-weighted MR imaging: diagnostic accuracy in patients imaged within 6 hours of stroke symptom onset. Radiology. 1999;210:155–162., se pueden detectar lesiones corticales o subcorticales pequeñas y lesiones isquémicas del tronco cerebral.
• Gregory A. Christoforidis, Yousef Mohammad, Dimitris Kehagias, Bindu Avutu, and Andrew P. Slivka. Angiographic Assessment of Pial Collaterals as a Prognostic Indicator Following Intra-arterial Thrombolysis for Acute Ischemic Stroke. AJNR Am J Neuroradiol 26:1789–1797, August 2005.
• Gubitz G, Sandercock P. Acute Ischaemic Stroke. BMJ 2000; 320: 692-6.).
• Guimaraens L, Vivas E, Sola T, Izquierdo J, Nasis N, Soler L, Benitez E, Leon M.A, Miquel, L. Stent assisted Angioplasty of intracranial Vertebrobasilar Atherosclerosis: The best Therapeutic optopn in Recurrent Transient Ischemic Events Unresponsive to Anticoagulant Treatments. Rivista di Neuroradiologia. 18:565-573. 2005.
• Guimaraens L. , Vivas E. , Sola T, Bedriñana M, Soler L, Balaguer E. Estenosis de tronco basilar: Stent + ATP como terapéutica de elección en pacientes refractarios a tratamiento medico. Intervencionismo, Diciembre 2002 (Sociedad Iberolatinoamericana de Intervencionismo).
• Guimaraens L., Vivas E., Sola T., Cuéllar H., Eva G., Martí J., Soler L. "Recanalización arterial en el ictus agudo utilizando stent autoexpandible." Rev Neurol. 2008.
• Hacke W, Kaste M, Olsen TS, Orgogozo JM, Bogousslavky. European Stroke Iniciative (EUSI). Recommendations for Stroke Management. The European Stroke Initiative Writing Committee. European Journal of Neurology 2000; 7: 607-23.).
• Haley EC Jr, Lyden PD, Johnston KC, et al. A pilot dose-escalation safety study of tenecteplase in acute ischemic stroke. Stroke 2005;36:607–12
• Hankey GJ, Warlow CP. (1999) Treatment and secondary prevention of stroke: evidence, costs, and effects on individuals and populación. Lancet, 354: 1457-63)
• Hoylaerts M, Rijken DC, Lijnen HR, et al. Kinetics of the activation of plasminogen by human tissue plasminogen activator. Role of fibrin. J Biol Chem. 1982;257:2912–2919.
• J. Thèron, O.Coskun, H.Huet, G.Oliveira, P.Toulas, G.Payelle. Local Intraarterial Throbolysis in the Carotid Territory. Interventional Neuroradiology 2:111-126,1996)
• J.Thèron, M.Nelson, F Alachkar and D.Mazia. Dynamic digitized cerebral parenchymography. Neuroradiology (1992) 34:361-364)
• Kaur J, Zhao Z, Klein GM, et al. The neurotoxicity of tissue plasminogen activator? J Cereb Blood Flow Metab 2004;24:945–63
• Kenneth Ouriel, MD A History of Thrombolytic Therapy J ENDOVASC THER 2004;11(Suppl II):II-128–II-133
• Kidwell CS, Villablanca JP, Saver JL. Advances in neuroimaging of acute stroke. Curr Atheroscler Rep. 2000;2:126 –135)
• Kloska SP, Nabavi DG, Gaus C, Nam EM, Klotz E, Ringelstein EB, Heindel W. Acute stroke assessment with CT: do we need multimodal evaluation? Radiology. 2004;233:79–86. Wintermark M, Fischbein NJ, Smith WS, Ko NU, Quist M, Dillon WP.
• Lindsberg PJ, Mattle HP. Therapy of basilar artery occlusion: a systematic analysis comparing intra-arterial and intravenous thrombolysis. Stroke. 2006 Mar;37(3):922-8. Epub 2006 Jan 26
• Macfarlane RG, Pilling JJ. Fibrinolytic activityof normal urine. Nature. 1947;159:779.
• Marks MP, Holmgren EB, Fox AJ, Patel S, von Kummer R, Froehlich J. Evaluation of early computed tomographic findings in acute ischemic stroke. Stroke. 1999;30:389 –392.
• Marler JR, Tilley BC, Lu M, Brott TG, Lyden PC, Grotta JC, Broderick JP, Levine SR, Frankel MP, Horowitz SH, Haley EC Jr, Lewandowski CA, Kwiatkowski TP. Early stroke treatment associated with better outcome: the NINDS rt-PA stroke study. Neurology. 2000;55: 1649–1655.
• Pérez-Sempere A. Morbilidad por enfermedad cerebrovascular en España: Incidencia y Prevalencia. Rev Neurol 1999; 29: 879-81.).
• Primary basilar artery stenting: immediate and long-term results in one patient. Piotin M, Blanc R, Kothimbakam R, Martin D, Ross IB, Moret J. AJR Am J Roentgenol. 2000 Nov;175(5):1367-9
• Qureshi AI, Siddiqui AM, Suri MF, et al. Aggressive mechanical clot disruption and low-dose intra-arterial third-generation thrombolytic agent for ischemic stroke: a prospective study. Neurosurgery 2002;51:1319 –27, discussion1327–29.
• Recommendations for Imaging of Acute Ischemic Stroke A Scientific Statement From the American Heart Association Richard E. Latchaw, MD, Chair; Mark J. Alberts, MD, FAHA; Michael H. Lev, MD, FAHA; John J. Connors, MD; Robert E. Harbaugh, MD, FAHA; Randall T. Higashida, MD, FAHA; Robert Hobson, MD, FAHA†; Chelsea S. Kidwell, MD, FAHA; Walter J. Koroshetz, MD; Vincent Mathews, MD; Pablo Villablanca, MD; Steven Warach, MD, PhD; Beverly Walters, MD; on behalf of the American Heart Association Council on Cardiovascular Radiology and Intervention, Stroke Council, and the Interdisciplinary Council on Peripheral Vascular Disease Stroke. 2009;40;3646-3678.
• Rejane C. Lisboa, Borko D. Jovanovic, and Mark J. Alberts Analysis of the safety and efficacy of intra-arterial thrombolytic therapy in ischemic stroke. Stroke. 2002 Dec;33(12):2866-71).
• RG Nogueira, L.H. Schwamm, .J.A Hirsch Endovascular approaches to Accute Stroke, Part 1: Drugs, Devices, and Data. AJNR Am J Neuroradiol. 30:649-61. Apr 2009.
• Rijken DC, Collen D. Purification and characterization of the plasminogen activator secreted by human melanoma cells in culture. J Biol Chem 1981;256:7035-7046.
• Schriger DL, Kalafut M, Starkman S, Krueger M, Saver JL. Cranial computed tomography interpretation in acute stroke: physician accuracy in determining eligibility for thrombolytic therapy. JAMA. 1998;279: 1293–1297.
• Sobel GW, Mohler SR, Jones NW, et al. Urokinase: an activator of plasma fibrinolysin extracted from urine. Am J Physiol. 1952;171: 768–769.
• Sussmann BJ, Fitch TSP. Thrombolysis with fibrinolysis in cerebral artery occlusion. JAMA 1958;167:1705–1709).
• The National Institute of Neurological Disorders and Stroke rt- PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Engl J Med 1995;333:1581–1587).
• Thrombolysis with alteplase for acute ischaemic stroke in the Safe Implementation of Thrombolysis in Stroke- Monitoring Study (SITS-MOST): an observational study Nils Wahlgren, Niaz Ahmed, Antoni Dávalos, Gary A Ford, Martin Grond, Werner Hacke, Michael G Hennerici, Markku Kaste, Sonja Kuelkens, Vincent Larrue, Kennedy R Lees, Risto O Roine, Lauri Soinne, Danilo Toni, Geert Vanhooren, for the SITS-MOST investigators. Lancet 2007; 369: 275–82.
• Tillett WS, Garner RL. The fibrinolytic activity of hemolytic streptococci. J Exp Med. 1933;58:485.
• Use of the Alberta Stroke Program Early CT Score (ASPECTS) for assessing CT scans in patients with acute stroke. AJNR Am J Neuroradiol. 2001 Sep;22(8):1534-42.
• Werner Hacke,MD, Markku Kaste, MD el all. Intravenous Thrombolysis with Recombinant Tissue Plasminogen Activator for Acute Hemispheric Stroke. Tue European Cooperative Acute Stroke Study (ECASS). JAMA. October 4 1995 –Vol 274 -13. 1017-59.
• Wintermark M, Reichhart M, Thiran JP, Maeder P, Chalaron M, Schnyder P, Bogousslavsky J, Meuli R. Prognostic accuracy of cerebral blood flow measurement by perfusion computed tomography, at the time of emergency room admission, in acute stroke patients. Ann Neurol.2002;51:417– 432..
• Zeumer H, Hacke W, Ringelstein EB. Local intraarterial thrombolysis in vertebrobasilar thromboembolic disease. AJNR Am J Neuroradiol 1983;4:401–404
- 22046 lecturas