Síndrome de Moya Moya
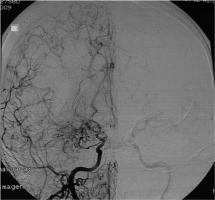
El síndrome de moyamoya es una rara enfermedad cerebrovascular que predispone a los pacientes afectados a sufrir ictus en relación con una progresiva estenosis de la arteria carótida interna y sus ramas principales (en la llamada porción T de la carótida interna). La reducción del flujo sanguíneo en los vasos principales de la circulación anterior del cerebro conduce al desarrollo compensatorio de circulación colateral a través de las pequeñas ramas penetrantes de la arteria carótida interna, la cerebral media y la cerebral anterior (es raro que se afecte la circulación posterior) (ver “Moyamoya1.jpg”). Se forman así prominentes canales anastomóticos, telangiectasias basales que aparecen en las angiografías como volutas de humo (parece ser que este es el significado en japonés de la palabra moyamoya) (Scott et al; 2009)
En su estudio etiológico es necesario excluir toda una serie de procesos que incluyen la arteriosclerosis, enfermedades autoinmunes, meningitis, neoplasias cerebrales, síndrome de Down, neurofibromatosis, trauma craneal o irradiación cefálica, entre otras. Si se encuentra una enfermedad causal se habla de síndrome de moyamoya. Por el contrario, los casos sin causa aparente, que suelen presentar afectación bilateral, se tipifican como enfermedad de moyamoya (Kuroda et al; 2008).
EPIDEMIOLOGÍA
Considerada inicialmente una enfermedad casi privativa de personas de herencia asiática (en Japón su prevalencia es de 3.16/100.00), se han identificado en los últimos años pacientes de todas las etnias. Afecta con más frecuencia (aproximadamente 2:1) a mujeres que a varones y tiene dos picos de incidencia, afectando sobre todo a niños de menos de quince años de edad y a adultos en la tercera a quinta décadas de la vida (Wakai et al; 1997).
FISIOPATOLOGÍA
Las observaciones intraoperatorias y anatomopatológicas muestran una significativa reducción del diámetro exterior de las arterias afectadas. En la arteria carótida interna distal se ha demostrado un engrosamiento fibrocelular de la capa íntima, una ondulación irregular de la elástica interna y una atenuación de la media (Takagi et al; 2007). En ningún caso se demuestran cambios arterioscleróticos ni inflamatorios. Procesos de apoptosis caspasa 3-dependientes podrían estar asociados con estos cambios histopatológicos. En algunos casos puede llegar a producirse un colapso de la luz arterial con subsiguiente trombosis.
Con respecto a los vasos moyamoya, se observan depósitos de fibrina en su pared, fragmentación de la lámina elástica, atenuación de la media y formación de microaneurismas (que explicarían las hemorragias que se producen en algunos pacientes). Probablemente todos estos cambios son secundarios al importante incremento en la cantidad de flujo que deben soportar (Lim et al; 2006).
La genética parece jugar un papel importante en el moyamoya, encontrándose en Japón hasta un 10% de familiares de primer grado del paciente afectos, siendo la herencia poligénica o asociada con una herencia autosómica dominante con penetrancia incompleta (Fukui et al; 2000).
Se han reportado niveles aumentados de muchos factores de crecimiento, enzimas y otros péptidos en los pacientes con moyamoya, incluyendo el factor de crecimiento de fibroblastos, el factor de crecimiento endotelial vascular, las metaloproteinasas de matriz y moléculas de adhesión intercelular, entre otras (Scott MR et al; 2009).
PRESENTACIÓN CLÍNICA
La presentación clínica es diferente en los niños y en los adultos. La mayoría de los niños se presentan con ataques isquémicos transitorios o infartos cerebrales, mientras que en más de la mitad de los adultos la enfermedad debuta en forma de hemorragias intracraneales, típicamente en el tálamo, ganglios basales o sustancia blanca profunda. En ocasiones pueden observarse hemorragias subaracnoideas e intraventriculares (Fukui et al; 2000).
Los síntomas isquémicos parecen seguir un patrón hemodinámico, y con frecuencia se describen factores precipitantes, tales como la hiperventilación o el llanto, el ejercicio, la inducción anestésica o la deshidratación (Tagawa et al; 1987).
Los eventos hemorrágicos, por su parte, se atribuyen a la ruptura de vasos colaterales frágiles, que en ocasiones son asiento de aneurismas (Iwama et al; 1997).
La cefalea también es un síntoma frecuente en el síndrome de moyamoya. Tiene características migrañosas y es refractaria a los tratamientos habituales, habiéndose atribuido a la dilatación de los vasos colaterales leptomeningeos que estimularían los nociceptores durales (Seol et al; 2005). Los vasos moyamoya de los ganglios basales también se han implicado en la génesis de movimientos coreiformes, que constituyen otra forma de presentación de esta patología (Parmar et al; 2000).
HISTORIA NATURAL Y PRONÓSTICO
La historia natural de la enfermedad es muy variable: en algunos pacientes la progresión puede ser lenta y en otros fulminante, sin que se haya identificado la causa de esta amplia variabilidad. Sea como sea, la enfermedad tiende a progresar: hasta 2/3 de los pacientes sufren nuevos síntomas en un plazo de 5 años (Choi et al; 1997). En cambio, tras el tratamiento quirúrgico la tasa de progresión sintomática se reduce a sólo un 2.6% (Fung et al; 2005).
En casos infantiles, estudios longitudinales han demostrado cómo el cociente intelectual comienza a declinar aproximadamente cinco años tras el diagnóstico de la enfermedad (Imaizumi et al; 1999).
DIAGNÓSTICO
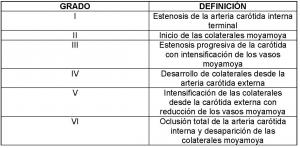
Es necesario considerar el síndrome de moyamoya como posibilidad diagnóstica en pacientes, sobre todo niños, que se presentan con síntomas de isquemia cerebral de causa inexplicada. El patrón oro para el diagnóstico sigue siendo la arteriografía convencional, utilizándose para su gradación la clasificación en seis estadíos establecida por Suzuki y Takaku (Suzuki et al; 1969) (ver “CLASIFICACIÓN DE SUZUKI.jpg).
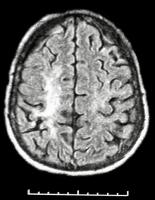
La angiografía mediante TAC puede revelar también las estenosis arteriales típicas del moyamoya, al igual que la angiografía por RM. Además la RM nos proporciona una mucho mejor definición de las lesiones parenquimatosas (ver “Moyamoya2.jpg”)
Adicionalmente el Doppler transcraneal, el PET, el SPECT o la TAC de perfusión pueden ayudarnos a cuantificar el flujo sanguíneo, a la monitorización evolutiva de los pacientes y a la toma de decisiones.
TRATAMIENTO
Ningún tratamiento puede revertir el proceso primario, de modo que todos los disponibles se orientan hacia la prevención del ictus mediante la promoción del flujo sanguíneo cerebral.
-Tratamiento médico
Es dudoso que los tratamientos médicos tengan alguna eficacia a corto o largo plazo, no existiendo evidencia alguna al respecto. Se han utilizado agentes antiplaquetarios para prevenir la embolización de microtrombos formados en los puntos de estenosis arterial. También se han recomendado los antagonistas del calcio como profilácticos de las cefaleas que a veces aquejan a estos pacientes, pero es necesario utilizarlos con precaución, ya que al provocar hipotensión podrían favorecer los ictus por mecanismos hemodinámicos (Hosain et al; 1994).
-Tratamiento quirúrgico
El hecho de que la arteria carótida externa no se afecte en esta enfermedad permite su utilización como fuente de flujo sanguíneo para el hemisferio isquémico. Se han propuesto dos métodos de revascularización: directo e indirecto (Veeravagu et al; 2008) En la revascularización directa, una rama de la arteria carótida externa (en general la arteria temporal superficial) se anastomosa directamente a una arteria cortical. Las ténicas indirectas pasan por la colocación de tejido vascularizado por la arteria carótida externa (duramadre, músculo temporal o la propia arteria temporal superficial) en contacto directo con el cerebro, lo que conduce a la proliferación de nuevos vasos hacia el córtex subyacente. Hay un considerable debate acerca de la conveniencia de utilizar cada uno de los dos métodos, y hay autores que se decantan por utilizar métodos combinados (Matsushima et al; 1998)
BIBILIOGRAFÍA
Choi JU, Kim DS, Kim EY, Lee KC (1997). Natural history of moyamoya disease: comparison of activity of daily living in surgery and non surgery groups. Clin Neurol Neurosurg; 99: Suppl 2: S11-S18.
Fukui M, Kono S, Sueishi K, Ikezaki K (2000). Moyamoya disease. Neuropathology ;20: Suppl: S61-S64.
Fung LW, Thompson D, Ganesan V(2005). Revascularisation surgery for paediatric moyamoya: a review of the literature. Childs Nerv Syst ; 21: 358-64.
Hosain SA, Hughes JT, Forem SL, Wisoff J, Fish I (1994). Use of a calcium channel blocker (nicardipine HCl) in the treatment of childhood moyamoya disease. J Child Neurol; 9: 378-80.
Imaizumi C, Imaizumi T, Osawa M, Fukuyama Y, Takeshita M (1999). Serial intelligence test scores in pediatric moyamoya disease. Neuropediatrics; 30: 294–99.
Iwama T, Morimoto M, Hashimoto N, Goto Y, Todaka T, Sawada M(1997). Mechanism of intracranial rebleeding in moyamoya disease. Clin Neurol Neurosurg ; 99: Suppl 2: S187-S190.
Kuroda S, Houkin K. (2008). Moyamoya disease: current concepts and future perspectives. Lancet; 7: 1056-66.
Lim M, Cheshier S, Steinberg GK (2006). New vessel formation in the central nervous system during tumor growth, vascular malformations, and Moyamoya. Curr Neurovasc Res; 3: 237-45.
Matsushima T, Inoue T, Ikezaki K, et al (1998). Multiple combined indirect procedure for the surgical treatment of children with moyamoya disease: a comparison with single indirect anastomosis with direct anastomosis. Neurosurg Focus; 5: e4.
Parmar RC, Bavdekar SB, Muranjan MN, Limaye U (2000). Chorea: an unusual presenting feature in pediatric Moyamoya disease. Indian Pediatr ; 37: 1005-9.
Scott MR, Smith R (2009). Moyamoya disease and moyamoya syndrome. N Eng J Med ; 360: 1226-37.
Seol HJ, Wang KC, Kim SK, Hwang YS, Kim KJ, Cho BK (2005). Headache in pediatric moyamoya disease: review of 204 consecutive cases. J Neurosurg; 103: Suppl: 439-42.
Suzuki J, Takaku A (1969). Cerebrovascular “moyamoya” disease: disease showing abnormal net-like vessels in base of brain. Arch Neurol; 20: 288-99.
Tagawa T, Naritomi H, Mimaki T, Yabuuchi H, Sawada T (1987). Regional cerebral blood flow, clinical manifestations, and age in children with moyamoya disease. Stroke; 18: 906-10.
Takagi Y, Kikuta K, Nozaki K, Hashimoto N. (2007). Histological features of middle cerebral arteries from patients treated for Moyamoya disease. Neurol Med Chir (Tokyo); 47: 1-4.
Veeravagu A, Guzman R, Patil CG, Hou LC, Lee M, Steinberg GK (2008). Moyamoya disease in pediatric patients: outcomes of neurosurgical interventions. Neurosurg Focus; 24: E16.
Wakai K, Tamakoshi A, Ikezaki K, et al (1997). Epidemiological features of moyamoya disease in Japan: findings from a nationwide survey. Clin Neurol Neurosurg; 99: Suppl 2: S1-S5.
- 98287 lecturas