Síndrome de Leucoencefalopatía Posterior Reversible
El síndrome de leucoencefalopatía posterior reversible (PRES), descrito en 1996 por Hinchey y colaboradores, es una entidad que inicialmente estaba asociada a trastornos atribuidos a la hipertensión arterial severa, eclampsia, alteraciones renales e inmunosupresión. El listado de causas se ha ampliado, y a continuación se describen los pacientes con mayor riesgo de presentar PRES.
Situaciones condicionantes de riesgo de PRES: [Bartynski WS; 2008a], [Fugate JE; 2010], [McKinney AM et al; 2007].
- Toxemia del embarazo: Preeclampsia, Eclampsia
- Post-trasplante: Transplante alogénico de médula ósea, Trasplante de órgano sólido
- Inmunosupresión: Ciclofosfamida, Ciclosporina, Tacrólimus, Micofenolato, Bevaciizumab, Rituximab, Vincristina, Metotrexate, Hidroxicloroquina, 5-Fluorouracilo, Sirolimus, Talidomida, Gemcitabina, Paclitaxel, Carboplatino, Sorafenib, Infliximab, hidroxiurea.
- Infección/sepsis/shock (asociación con gérmenes gram positivos): Síndrome de respuesta inflamatoria sistémica, Síndrome de disfunción multiorgánica
- Enfermedades autoinmunes: Lupus Eritematoso Sistémico, Esclerodermia, Síndrome de Wegener, Poliarteritis Nodosa, Púrpura Trombótica Trombocitopénica, Hipotirodismo, Enfermedad de Crohn, Colitis ulcerosa, Colangitis esclerosante primaria, Artritis Reumatoide, Diabetes Mellitus tipo I, Enfermedad de Graves, Tiroiditis de Hashimoto, Síndrome de antifosfolípido, Hepatitis autoinmune, Tromboangeítis obliterante, Síndrome autoinmune poliglandular, Síndrome de Sjögren, Nefritis intersticial granulomatosa.
- Post-tratamiento quimioterápico: Quimioterapia combinada a dosis altas, Citarabina, Cisplatino, Gemcitabina, Tiazofurin, Bevacizumab (Avastin), Inhibidor de Kinasa BAY 34-9006.
- Diversas asociaciones comunicadas: Hipomagnesemia, Hipercalcemia, Hipocolesterolemia, Immunoglobulina intravenosa, Síndrome de Guillain-Barré, Porfiria, Sobredosis de Efedrina, Dislisis/eritropoyetina, Triple-H terapia, Síndrome de lisis tumoral, Peróxido de hidrógeno, Células indiferenciadas de dimetilsulfóxido.
La presentación clínica más frecuente es en forma de convulsiones de nueva aparición, encefalopatía, cefalea y alteraciones visuales [Fugate JE et al, 2010], aunque también se han descrito casos de paresia, nauseas y alteración mental, ya sea de inicio brusco o progresivo [Bartynski WS; 2008a]. Las crisis generalizadas son comunes e incluso se puede llegar al coma.
La hipertensión moderada a severa está presente en el 70-80% de los casos. Sólo en un 20-30% de los pacientes con eclampsia o trasplante de médula ósea, las cifras de tensión arterial son normales o mínimamente elevadas [Bartynski WS; 2008]. La hipertensión arterial no es un dato constante (25% de los pacientes no la presentan) y aún cuando está presente no siempre alcanza los límites del fallo de la autorregulación [Bartynski WS; 2008a]. En humanos, el límite inferior de la autorregulación estaría aproximadamente entre 40-60 mm Hg de presión arterial media (2/3 TA diastólica + 1/3 TA sistólica) y el límite superior estaría entre 150-160 mm de Hg de presión arterial media. Es por ello, que se barajan dos teorías como origen fisiopatológico [Bartynski WS; 2008b]. La teoría más popular y más aceptada está basada en la hipertensión, fallo de la autorregulación e hiperperfusión, y la segunda teoría estaría relacionada con fenómenos de vasoconstricción, hipopefusión e isquemia [Bartynski WS; 2008a]. La hipertensión severa que exceda el límite superior de la capacidad de autorregulación de las arterias cerebrales, puede conducir a una hiperperfusión, lo que iría a favor de la primera teoría [Bartynski WS, 2008a], [Bartynski WS; 2008b], [Hefzy HM et al; 2009], lo cual es más manifiesto en el territorio de la arteria cerebral posterior por la menor densidad de inervación simpática del territorio vertebrobasilar. A favor de la segunda teoría, por el contrario, fenómenos de vasoconstricción e hipoperfusión también han sido descritos [Bartynski WS; 2008a], [Bartynski WS; 2008b], [Hefzy HM et al; 2009], con una afectación cerebral que sigue la distribución de los territorios frontera.
Los hallazgos radiológicos más característicos muestran la presencia de edema vasogénico focal, parcheado, o en menor grado confluente, que afecta preferentemente a las regiones parieto-occipitales. De forma adicional puede haber afectación de los lóbulos frontales, región temporo-occipital inferior y cerebelo. El edema vasogénico que afecta al lóbulo frontal típicamente se caracteriza por ser lineal a lo largo del surco frontal superior. Existen otras afectaciones menos esperables como las de localización en el tronco cerebral (mesencéfalo, protuberancia y afectación de la médula espinal), ganglios basales, tálamo, núcleo caudado, sustancia blanca profunda y rodete del cuerpo calloso. La distribución suele ser bilateral aunque puede ser asimétrica. Fenómenos hemorrágicos están descritos entre un 8-17% de los casos (hematoma focal único o multiple, hemorragia subaracnoidea). [Hefzy HM et al; 2009], [Bartynski WS, Boardman JF; 2007] [McKinney AM et al; 2007].
Estos hallazgos en el TC se traducen como focos parcheados de hipodensidades que se distribuyen principalmente en el territorio de la circulación posterior. Ocasionalmente pueden observarse focos de hemorragia, ya sea parenquimatosa (petequias de distribución cortical o subcortical, así como afectación de la región ganglionar basa) o subaracnoidea [McKinney AM et al; 2007]. Puede haber un realce parcheado, puntiforme tras la administración de contraste yodado. [Osborn AG; 2004]
La Resonancia Magnética juega un papel más relevante en el diagnóstico. Las lesiones se presentan como hipointensas en las imágenes potenciadas en T1 y de hiperseñal en imágenes potenciadas en T2 y FLAIR. Las imágenes potenciadas en difusión suelen ser normales ( el edema vasogénico no muestra restricción del agua) y el mapa de coeficiente de difusión aparente muestra áreas de aumento de señal. Las secuencias potenciadas en T1 tras administración de contraste paramagnético pueden mostrar un realce parcheado variable. [Osborn AG; 2004]
Los estudios realizados de imagen vascular cerebral mediante angio-RM, Angio-CT y angiografía convencional con sustracción digital pueden evidenciar signos de vasculopatía, con vasoconstricciones focales o difusas, vasodilataciones focales, oclusiones arteriales o irregularidades arteriales. El edema vasogénico es menor en los pacientes hipertensos en comparación con los pacientes normotensos. [Bartynski WS, Boardman JF; 2008] [Bartynski WS, Boardman JF; 2006]
Los estudios de Perfusión-RM muestran una reducción del volumen cerebral relativo cortical en las lesiones por encefalopatía posterior reversible. [Bartynski WS, Boardman JE; 2008]
Los hallazgos radiológicos revierten de forma completa o prácticamente completa en la gran mayoría de los casos. [Fugate JE; 2010]
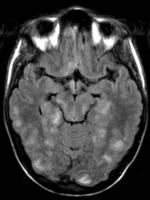
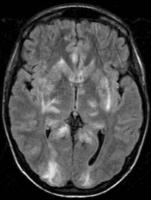
Fig. 1 y 2: Imágenes de RM Axial FLAIR que muestran focos de hiperseñal de distribución cortical y subcortical temporo-occipital y región ganglionar basal bilateral.
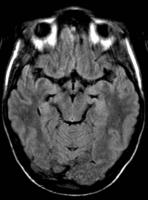
Fig. 3 y 4: Imágenes de RM Axial FLAIR del mismo paciente, con reversibilidad de los hallazgos.
BIBLIOGRAFÍA
- Bartynski WS. (2008). Posterior Reversible Encephalopathy Syndrome, Part 1: Fundamental Imagin and Clinical Features. Am J Neuroradiol. 29:1036-42.
- Bartynski WS. (2008). Posterior Reversible Encephalopathy Syndrome, Part 2: Controversies Surrounding Pathophysiology of Vasogenic Edema. Am J Neuroradiol. 29:1043-9.
- Bartynski WS, Boardman JF. (2008). Catheter Angiography, MR Angiography,and MR Perfusion in Posterior Reversible Encephalopathy Syndrome. Am J Neuroradiol. 29: 447-55.
- Bartynski WS, Boardman JF. (2007). Distinct Imaging Patterns and Lesion Distribution in Posterior Reversible Encephalopathy Syndrome. Am J Neuroradiol. 28: 1320-7.
- Bartynski WS, Boardman JF. (2006). Posterior Reversible Encephalopathy Syndrome in Infection, Sepsis, and Shock. Am J Neuroradiol. 27: 2179-90.
- Fugate JE, Claassen DO, Cloft HJ, Kallmes DF, Kozak OS, Rabinstein AA. (2010). Posterior Reversible Encephalopathy Syndrome: Associated ClinicaL and Radiologic Findings. Mayo Clin Proc. 85(5): 427-32.
- Hefzy HM, Bartynski WS, Boardman JF, Lacomis D. (2009). Hemorrhage in Posterior Reversible Encephalopathy Syndrome: Imaging and Clinical features. An J Neuroradiol. 30: 1371-79.
- Covarrubias DJ, Luetmer PH, Campeau NG. (2002). Posterior Reversible Encephalopathy Syndrome: Prognostic Utility of Quantitativa Diffusion-Weighted M Images. Am J Neuroradiol. 23: 1038-48.
- Osborn AG (Ed.). (2004). Diagnostic Imaging Brain. (pp I-10: 28-35). Canadá: AMIRSYS.
- McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCrz KS, Teksam M. (2007). Posterior Reversible Encephalopathy Syndrome: Incidene of Atypical Regions of Involvement and Imaging Findings. AJR. 189: 904-12.
- 85282 lecturas