Síndrome de Hiperperfusión
INTRODUCCIÓN Y FISIOPATOLOGÍA:
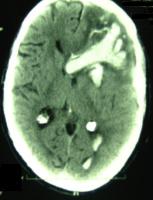
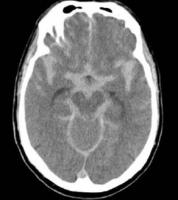
El síndrome de hiperperfusión (SHP) es un cuadro infrecuente de daño cerebral agudo secundario a la revascularización de una arteria previamente obstruida u estenosada. El término es a veces intercambiable con el de síndrome de reperfusión. Se considera que se produce hiperperfusión, cuando el flujo sanguíneo cerebral regional se incrementa un 100% con respecto a sus valores basales, y la reperfusión propiamente dicha ocurre cuando se revascularizan arterias previamente ocluidas, como puede ser el caso de la arteria cerebral media tras el tratamiento trombolítico. El SHP generalmente de da en pacientes con alteración de la reserva hemodinámica, que presentan una capacidad de autorregulación previamente deteriorada. La arteria cuya revascularización ocasiona generalmente este síndrome es la carótida interna tras procedimientos de endarterectomía o angioplastia, pero también puede darse cuando se revascularizan otras arterias intracraneales o cervicales. La mala capacidad de adaptación de las arteriolas a la nueva situación de hiperaflujo tras producirse la revascularización, las hace incapaces de vasoconstreñirse, con lo cual se produce una situación de edema cerebral en el hemisferio revascularizado, capaz de alterar sus funciones, y pudiendo en los casos graves producir hemorragias cerebrales graves, que suelen ser intraparenquimatosas (ver Figura 1 jpg), o raramente hemorragias subaracnoideas (Ver Figura 2 jpg).
Una entidad ligada a esta fisiopatología es la encefalopatía tras extravasación de contraste ó encefalopatía postcontraste, en la que el paso de contraste a través de la barrera hematoencefálica genera una trasudación del mismo al parénquima cerebral, originando un cuadro clínico similar. La intensidad de la extravasación del contraste está relacionada con los cambios hemodinámicos durante el procedimiento, la cantidad de contraste empleado, y también es más frecuente en pacientes con precaria capacidad de autorregulación basal. (Canovas 2007).
Figura 1: Hemorragia frontal izquierda secundaria a síndrome de hiperperfusión tras colocación de stent carotídeo en paciente de edad avanzada.
Figura 2: Hemorragia subaracnoidea masiva tras colocación de stent carotídeo en paciente con oclusión carotídea contralateral.
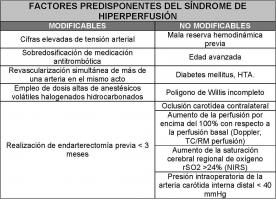
Factores predisponentes: Entre ellos destacan la edad avanzada, la oclusión carotídea contralateral, el aumento de la perfusión por encima del 100% con respecto a la perfusión basal, la revascularización simultánea de más de un vaso en el mismo acto, la sobredosificación de medicación antitrombótica y, sobre todo, la presencia de una mala reserva hemodinámica previa. Entre los factores predisponentes modificables destacan las cifras elevadas de tensión arterial y como decimos, la sobredosificación de medicación antitrombótica.
Tabla 1: Factores predisponentes. NIRS: Near infrared spectroscopy. HTA: Hipertensión arterial.
CLÍNICA
La clínica se suele instaurar a las pocas horas de realizarse la revascularización, en el caso de las angioplastias carotídeas, y a los pocos días, en el caso de las endarterectomías. Suele cursar con cefalea, elevación de las cifras de presión arterial, alteración del nivel de conciencia, y focalidad neurológica contralateral al hemisferio afecto. Pueden asociar con frecuencia crisis comiciales parciales y/o generalizadas y vómitos.
DIAGNÓSTICO
TC craneal:La prueba complementaria inicial que se suele realizar es un TC craneal, para descartar la presencia de hemorragias. El parénquima por lo general es normal, aunque puede revelar datos de edema cerebral ipsilateral al hemisferio revascularizado. Si se completa el estudio con angio TC y técnicas de perfusión, se comprobará que no existe oclusión arterial ni datos de isquemia, si no por el contrario una situación de hiperemia local.
Doppler transcraneal: El doppler transcraneal permite detectar un aumento de las velocidades medias, reflejo también de la situación de hiperaflujo. Es más valioso tener un estudio basal para comprobar el incremento de la velocidad media en un 100 % tras la técnica revascularizadora.
TRATAMIENTO Y PREVENCIÓN
Es muy importante identificar a aquellos pacientes con factores de riesgo para desarrollar este síndrome, de cara a instaurar una vigilancia más estrecha tras el procedimiento revascularizador, en base a los factores predisponentes mencionados (Ver Tabla 1 jpg). En este contexto se pueden realizar pruebas para evaluar la reserva hemodinámica en los pacientes con sospecha de que esta esté alterada, como estudios de doppler transcraneal con test de apnea, inhalación carbógeno o infusión de azetazolamida, TC craneal de perfusión con infusión de azetazolamida o inhalación de Xenon 133, RM de perfusión, SPECT, o PET. Aparte de la monitorización clínica, se debe realizar en los pacientes susceptibles un cuidado estrecho de las cifras de presión arterial y de la dosificación de medicación antitrombótica. En los pacientes endarterectomizados se ha empleado el doppler transcraneal como herramienta predictiva, de tal modo que cuando objetiva aumentos de la velocidad mayores del 100% en la arteria cerebral media, con respecto a las cifras previas a la intervención, se considera una situación de riesgo. Algunos autores recomiendan la realización de esta técnica en las horas siguientes a este tipo de intervención para seleccionar los pacientes que están en situación de mayor riesgo, en los que haya que realizar un control más enérgico de las cifras de tensión arterial. En pacientes sometidos a angioplastia con stent se ha empleado la monitorización incruenta con técnicas que miden la saturación regional de oxígeno (rSO2) mediante oximetría por infrarrojos (NIRS: Near-infrared spectroscopy), observando que cuando esta aumenta >24% a los 3 minutos de la revascularización se asocia al desarrollo de un síndrome de hiperperfusión (Ando 2009). La detección de descargas laterales periódicas epileptiformes durante la realización de electroencefalografía intraprocedimiento es otro hallazgo relacionado con el desarrollo de SHP. Se ha propuesto premedicar a los pacientes con medicamentos antioxidantes (scavengers), como el edavarone, para neutralizar el daño que ocasionan los radicales libres al producirse la reperfusión. Como agente anestésico para la intervención se prefiere el isofluorano, con menos efectos vasodiltadores, y se considera una actitud de riesgo el empleo de dosis altas de anestésicos volátiles halogenados hidrocarbonados. El grupo de fármacos que pueden usarse para el control de la hipertensión es muy restringido, pues se trata de evitar todos aquellos que puedan producir vasodilatación cerebral, siendo de este modo contraproducentes los nitratos, los calcioantagonistas y los inhibidores de la enzima convertidora de la angiotensina, pasando a ser de elección el labetalol y la clonidina. Para el tratamiento del edema cerebral se han empleado corticoides (dexametasona 4 mg/6h intravenosos), manitol, suero salino hipertónico, hiperventilación y barbitúricos. En caso de que el SHP asocie crisis comiciales se instaurará tratamiento anticonvulsivante.
BIBLIOGRAFÍA:
• Ando, M. Takezawa and J. I. Kira S. Matsumoto, I. Nakahara, T. Higashi, Y. Iwamuro, Y. Watanabe, K. Takahashi, M (2009). Near-infrared spectroscopy in carotid artery stenting predicts cerebral hyperperfusion syndrome Neurology;72;1512-1518
• Canovas D et al (2007). Extravasación de contraste tras stent carotídeo con clínica de infarto cerebral Neurología 22(3); 187-190.
• Van Mook W, Rennenberg, Schurink, van Oostenbrugge, Mess, Hofman, (2005). Cerebral hyperperfusion syndrome. Lancet Neurol; 4: 877–88.
- 63302 lecturas