Ictus Aterotrombótico
INTRODUCCIÓN: CONCEPTO Y CLASIFICACIÓN
El ictus aterotrombótico se define como aquel ictus isquémico secundario a la enfermedad ateromatosa que afecta a los troncos supraaórticos y a las grandes arterias intracraneales.
Existen diversas clasificaciones etiopatogénicas, que proponen diferentes definiciones para el ictus aterotrombótico. La clasificación recomendada por el Grupo de Estudio de Enfermedades Cerebrovasculares (GEECV) de la Sociedad Española de Neurología (SEN) (Arboix et al; 1998) (Arboix et al; 2002) es una adaptación de la Lausanne Stroke Registry (LSR) (Bogousslavsky et al; 1997), que requiere la presencia de al menos uno de los dos criterios siguientes, para el diagnóstico de ictus aterotrombótico:
a) Arteriosclerosis con estenosis > 50% del diámetro luminal u oclusión de la arteria extracraneal correspondiente o de la arteria intracraneal de gran calibre (cerebral media, cerebral posterior o tronco basilar) en ausencia de otra etiología, o
b) Arteriosclerosis sin estenosis hemodinámicamente significativa, pero con presencia de placas o estenosis menores del 50% en la arteria extracraneal correpondiente o en la arteria intracraneal de gran calibre (cerebral media, cerebral posterior o tronco basilar), en ausencia de otra etiología y en presencia de al menos dos factores de riesgo vascular: edad mayor de 50 años, hipertensión arterial, diabetes mellitus, tabaquismo o hipercolesterolemia.
EPIDEMIOLOGÍA
Según los criterios LSR, el ictus aterotrombótico representa del 25-45% de todos los ictus en mayores de 50 años (Carrera et al; 2007). La mayoría son debidos a arteriosclerosis extracraneal, mientras que la arteriosclerosis intracraneal representa sólo un 5-10% de los ictus aterotrombóticos.
ETIOLOGÍA
La arteriosclerosis constituye una enfermedad sistémica de la capa íntima de las arterias de mediano y gran calibre, caracterizada por la proliferación de células musculares lisas y depósito de lípidos, que comienza varias décadas antes del cuadro clínico.
Entre los factores de riesgo implicados en el desarrollo de esta enfermedad se incluyen, entre otros, la edad avanzada, tabaquismo, hipertensión arterial, hipercolesterolemia, diabetes mellitus, obesidad (sobre todo abdominal), elevación de homocisteína, factores trombogénicos, etc (Medrano et al; 2005).
En el territorio carotídeo, la mayoría de las lesiones arterioscleróticas se localizan en el origen de la arteria carótida interna, con menor frecuencia en la porción intracraneal del sifón carotídeo, y de manera excepcional, en las arterias cerebrales anteriores y medias (excepto en la raza negra, en que las lesiones ateroscleróticas intracraneales son más frecuentes). Por su parte, en la circulación posterior, las placas de ateroma se sitúan fundamentalmente en ambos extremos de la arteria basilar.
En general, las placas de ateroma no complicadas localizadas en la circulación carotídea no producen manifestaciones clínicas hasta que alcanzan estenosis superiores al 90%, comprometiendo el flujo sanguíneo cerebral. Con más frecuencia, los síntomas aparecen por las alteraciones de la propia lesión ateromatosa, la cual puede ulcerarse y originar un trombo, que puede ocluir localmente la luz arterial o embolizar y ser arrastrado por la corriente sanguínea, ocluyendo vasos distales. En la circulación vertebrobasilar, además de presentar estas complicaciones, pequeñas placas ateromatosas no complicadas, pueden ocluir la salida de pequeñas arterias penetrantes, produciendo infartos lacunares.
Desde el punto de vista etiológico, existen discrepancias entre autores sobre la conveniencia de incluir dentro del grupo de ictus aterotrombóticos, aquellos ictus provocados por enfermedad de gran vaso de naturaleza no ateromatosa, como sería el caso de las disecciones arteriales, displasia fibromuscular, arteritis, enfermedad de moyamoya, etc.
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas dependen del territorio vascular afectado, constituyendo los denominados síndromes neurovasculares, que permiten realizar un diagnóstico topográfico aproximado de la lesión. Se han descrito una serie de características clínicas que sugieren una etiología aterotrombótica del ictus:
Antecedente de ataque isquémico transitorio (AIT) en el mismo territorio vascular (hasta en un tercio de los pacientes con infarto cerebral secundario a aterosclerosis). El riesgo de ictus es mayor en los AIT carotídeos y en los dos meses siguientes al episodio transitorio.
Presencia de coronariopatía o arteriopatía periférica.
Debut de la focalidad neurológica durante el sueño o al despertar.
Desarrollo del infarto en unas pocas horas.
DIAGNÓSTICO
Las técnicas para la visualización del árbol arterial carotídeo extra e intracraneal incluyen:
1. Estudio neurovascular mediante ultrasonidos.
• Estudio de troncos supraaórticos. Permite valorar la existencia de estenosis carotídeas hemodinámicamente relevantes. Existen una serie de criterios para la estimación del grado de estenosis de la arteria carótida interna (ACI), basados en la velocidad sistólica máxima, el cociente carótida común/carótida interna y la velocidad diastólica máxima (Grant et al; 2003) (Tabla 1) (Ver Tabla 1 jpg) (de Bray et al; 1995).
• Estudio doppler transcraneal (DTC). En presencia de una estenosis carotídea extracraneal, el DTC puede aportar información sobre la presencia de una adecuada circulación colateral, lo que resulta imprescindible si se plantean tratamientos de revascularización. Asimismo, el DTC permite el diagnóstico y seguimiento no invasivo de las estenosis intracraneales (Rorick et al; 1994).
Tabla 1. Criterios diagnósticos de consenso para la evaluación del grado de estenosis.
2. Angiografía por tomografía computarizada (angio-TC).
Permite el estudio de los vasos sanguíneos tras la administración de contraste yodado. Es útil para la detección de suboclusiones carotídeas en pacientes con estudio ultrasonográfico dudoso, pero puede infraestimar el grado de estenosis en caso de grandes placas muy calcificadas. Además, su precisión diagnóstica disminuye significativamente en las oclusiones distales.
3. Angiografía por resonancia magnética (angio-RM).
La sensibilidad y especificidad de la angio-RM para la detección de estenosis de alto grado es del 95% y 90%, respectivamente y del 98 y 100%, para la detección de la oclusión carotídea completa (Nederkoorn et al; 2003). Su principal inconveniente es la sobrestimación de la estenosis debido a la presencia de flujos lentos.
4. Angiografía convencional.
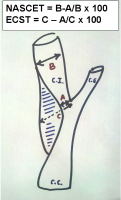
Hoy en día la angiografía de troncos supraaórticos continúa siendo la prueba de referencia para la medición exacta del grado de estenosis. Permite, además, visualizar la morfología de la placa de ateroma e identificar imágenes sugestivas de ulceración en el interior de la misma. Asimismo, permite también el estudio de las estenosis intracraneales, lográndose la visualización de ramas de muy pequeño diámetro. Existen dos métodos para medir la estenosis carotídea: el método del North American Symptomatic Carotid Endarterectomy Trial, NASCET (Barnett et al; 1998), basado en el porcentaje de reducción del diámetro del vaso en función del diámetro más próximo sano, y el método del European Carotid Surgery Trial, ECST, basado en el porcentaje de reducción del diámetro del vaso en función del diámetro teórico (Ver Figura 1 jpg).
Figura 1. Cuantificación del grado de estenosis carotídea. C.I.: Carótida interna; C.E: Carótida externa. C:C.: Carótida común.
TRATAMIENTO
1. Tratamiento en fase aguda.
Medidas generales. Es fundamental el control de la presión arterial, glucemia e hipertermia, así como la prevención y tratamiento de complicaciones neurológicas (crisis comiciales, hipertensión intracraneal…) y extraneurológicas (broncoaspiración, trombosis venosa profunda, etc).
Tratamiento específico.
A. Tratamiento antitrombótico. Se recomienda iniciar el tratamiento con aspirina, salvo contraindicación, en las primeras 48 horas tras el ictus (Adams et al; 2007), ya que parece asociarse a un descenso pequeño, pero estadísticamente significativo, de la morbimortalidad. Los datos actuales indican que la administración temprana de heparina o heparinas no fraccionadas de bajo peso molecular (HBPM) no disminuye el riesgo de empeoramiento neurológico ni de recurrencia precoz del ictus, por lo que no se recomienda su uso.
B. Tratamiento trombolítico. La aplicación de fármacos trombolíticos en el infarto cerebral agudo tiene como objetivo la lisis del trombo, y por tanto, la recanalización del vaso ocluido, y finalmente, la reperfusión del tejido cerebral. En la actualidad puede administrarse de tres modos: por vía intravenosa, intraarterial o combinada.
2. Prevención secundaria.
Tratamiento farmacológico
A. Tratamiento antitrombótico. El tratamiento antiagregante (ácido acetilsalicílico, ticlopidina, clopidogrel, triflusal), es el más empleado y del que existe mayor evidencia científica en cuanto a su utilidad en la reducción del riesgo de nuevos eventos cerebrovasculares. Numerosos estudios han buscado el beneficio del tratamiento anticoagulante oral en la prevención secundaria en pacientes con ictus aterotrombótico, sin embargo, ninguno de ellos demostró su superioridad, presentando en cambio, una mayor tasa de complicaciones hemorrágicas (Mohr et al; 2001).
B. Tratamiento antihipertensivo. Diversos estudios han sugerido una fuerte relación lineal entre las cifras habituales de presión arterial y el riesgo de ictus en pacientes con ictus isquémico previo (Rodgers et al; 1996).
C. Estatinas. Aunque sigue siendo controvertido si los niveles séricos elevados de colesterol constituyen un factor de riesgo para el ictus, en estudios clínicos recientes se ha demostrado que las estatinas reducen significativamente el riesgo de ictus en pacientes con patología vascular, incluyendo pacientes con ictus (Paciaroni et al; 2007). De esta manera, los resultados del ensayo clínico Stroke prevention by aggressive reduction in colesterol levels (SPARCL) (Amarenco et al; 2006), proporcionaron suficiente evidencia como para recomendar la atorvastatina (80 mg/día) en la prevención secundaria del ictus aterotrombótico.
Tratamiento no farmacológico
Las principales recomendaciones en relación a las intervenciones en prevención secundaria del ictus aterotrombótico (endarterectomía vs angioplastia), se recogen en la Tabla 2 (Calleja et al; 2008).
Tabla 2. Intervenciones en prevención secundaria del ictus aterotrombótico (adaptada de Calleja A. *En los casos en que está indicada, la cirugía debería realizarse tan pronto como sea posible tras el evento isquémico cerebral, idealmente antes de dos semanas. AIT: ataque isquémico transitorio, ACI: arteria carótida interna.
BIBLIOGRAFÍA
Adams HP Jr, del Zoppo G, Alberts MJ et al. Guidelines for the early management of adults with ischemic stroke: a guideline from the American Heart Association/American Stroke Association Stroke Council, Clinical Cardiology Council, Cardiovascular Radiology and Intervention Council, and the Atherosclerotic Peripheral Vascular Disease and Quality of Care Outcomes in research interdisciplinary working groups. Stroke 2007; 38: 1655-711.
Amarenco P, Bogousslavsky J, Callahan A et al. High-dose Atorvastatin after stroke or transient ischemic attack. The Stroke Prevention by aggressive reduction in Cholesterol levels (SPARCL) investigators. N Engl J Med 2006; 355: 549-59.
Arboix A, Alvarez-Sabín J, Soler L en nombre del Comité de Redacción ad hoc del Grupo de estudio de Enfermedades Cerebrovasculares de la SEN. Ictus. Clasificación y criterios diagnósticos. Neurología 1998; 13: 3-10.
Arboix A, Díaz J, Pérez-Sempere A, Alvarez-Sabín J en nombre del Comité de Redacción ad hoc del Grupo de estudio de Enfermedades Cerebrovasculares de la SEN. Ictus. Tipos etiológicos y criterios diagnósticos. Neurología 2002; 17: 3-12.
Barnett HJ, Taylor DW, Eliasziw M et al. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. North American Symptomatic Carotid Endarterectomy Trial collaborators. N Engl J Med 1998; 339:1415-1425.
Bogousslavsky J, Van Melle G, Regli F. The Lausanne Stroke Registry: analysis of 1,000 consecutive patients with first stroke. Stroke 1988; 19: 1083-92.
Calleja AI, Arenillas JF. (2008). Historia natural y prevención del ictus aterotrombótico. En: Montaner J (Ed), Prevención del ictus isquémico, (pp 141-154). Barcelona: ICG Marge.
Carrera E, Maeder-Ingvar M, Rossetti AO, Devuyst G, Bogousslavsky J. Trends in risk factors, patterns and causes in hospitalized strokes over 25 years: the Lausanne Stroke Registry. Cerebrovasc Dis 2007; 24:97-103.
De Bray JM, Glatt B. For the International Consensus Conference. Quantification of atheromatosis in the extracranial internal carotid artery. Cerebrovasc Dis 1995; 5: 414-426.
Grant EC, Benson CB, Moneta GL et al. Carotid artery stenosis: Gray scale and doppler US diagnosis -Society of Radiologists in ultrasound consensus conference. Radiology 2003; 229: 340-346.
Medrano MJ, Cerrato E, Boix R, Delgado-Rodríguez M. Factores de riesgo cardiovascular en población española. Med Clin (Barc) 2005; 124:606-612.
Mohr JP, Thompson JL, Lazar RM et al. A comparison of warfarin and aspirin for the prevention of recurrent ischemic stroke. N Engl J Med 2001; 345: 1444-1451.
Nederkoorn PJ, van der Graaf Y, Hunink MG. Duplex ultrasound and magnetic resonance angiography compared with digital substraction angiography in carotid artery stenosis: a systematic review. Stroke 2003; 34:1324-1332.
Paciaroni M, Hennerici M, Agnelli G et al. Statins and stroke prevention. Cerebrovasc Dis 2007; 24: 170-82.
Rodgers A, MacMahon S, Gamble G, Slattery J, Sandercock P, Warlow C. Blood pressure and risk of stroke in patients with cerebrovascular disease. The United Kingdom Transient Ischemic Attack collaborative group. Br Med J 1996; 313: 147.
Rorick MB, Nichols FT, Adams RJ et al. Transcranial doppler correlation with angiography in detection of intracranial stenosis. Stroke 1994; 25: 1931-34
- 58815 lecturas