Endarterectomía Carotídea
INTRODUCCIÓN
El ICTUS es la tercera causa de mortalidad en el mundo occidental. Tras un primer episodio, un tercio de los pacientes se recuperarán, un tercio morirán y un tercio sufrirán secuelas, siendo la principal causa de discapacidad en los adultos (Bonita R, 1992). El 80% son de origen isquémico, existiendo ateromatosis carotídea en el 20-30% de los casos (Timsit SG, 1992). Se estima que al menos un millón de europeos tienen una estenosis carotídea severa (Rudarakanchana N, 2010).
La primera endarterectomía carotídea (EAC) se realizó en 1954 para tratar a una mujer de 66 años con 33 episodios previos de AIT, tras la cirugía los síntomas desaparecieron por completo (Eastcott HH, 1954). Desde entonces, esta técnica se ha convertido en una de las intervenciones mas frecuentes en los servicios de Cirugía Vascular. Su objetivo fundamental es la prevención, tanto primaria como secundaria, del ICTUS. Como veremos, ha demostrado su utilidad comparada con el tratamiento farmacológico tanto en pacientes con síntomas neurológicos previos como en pacientes asintomáticos. Por ello las guías actuales, basándose en estudios multicéntricos, prospectivos y aleatorizados, continúan considerando la EAC como la primera opción en el tratamiento de la estenosis carotídea (Sacco RL, 2006; Goldstein LB, 2006).
INDICACIONES
El primer paso en la prevención es identificar aquellos pacientes con una estenosis carotídea significativa que se encuentren en mayor riesgo de ICTUS y que por tanto podrían beneficiarse del tratamiento quirúrgico. A continuación se exponen las indicaciones más aceptadas, aportadas por los estudios NASCET, ECST, ACAS y ACST, que analizaremos en el apartado de resultados.
- Pacientes sintomáticos.
Ataque Isquémico Transitorio: El riesgo de ICTUS en pacientes con un ataque isquémico transitorio no tratado es del 10% el primer año, posteriormente se mantiene una tasa del 6% anual, disminuyendo a partir de los 3 años (Sze PC, 1998). Tras la EAC en pacientes con AIT asociado a una lesión carotídea, el riesgo de ICTUS desciende hasta menos del 1% (Krupski WC, 2006).
ICTUS: La tasa de recurrencia anual del ICTUS es del 9%, no disminuyendo con el tiempo (Sacco RL 1982). La EAC disminuye este riesgo hasta menos del 2% al año (Makhoul RG 1993). En general se acepta la indicación quirúrgica en pacientes que han sufrido un ICTUS con recuperación completa o parcial, no ofreciendo beneficio a aquellos pacientes con déficits neurológicos graves y persistentes.
- Pacientes asintomáticos.
La estenosis carotídea asintomática constituye una de las indicaciones más frecuentes, siendo la que genera mayores debates. Una estenosis carotídea significativa (>70%) se asocia a un riesgo de ICTUS del 3 al 5% por año de seguimiento (Norris JW, 1991). La selección de los pacientes es fundamental, recomendándose la EAC únicamente en pacientes con buen estado clínico, una esperanza de vida superior a 5 años y en centros con una morbimortalidad perioperatoria menor del 3% (Goldstein LB, 2001).
- Controversias.
ICTUS en evolución: La tasa de ICTUS/muerte en este tipo de pacientes supera el 20% si se realiza una EAC en fase aguda, por lo que sólo deben ser tratados por equipos con mucha experiencia, aceptando un porcentaje elevado de secuelas neurológicas (Mentzer RM, 1981).
Placas ulceradas en pacientes asintomáticos: Las evidencias sobre el tratamiento de este tipo de lesiones se basan en estudios retrospectivos no multicéntricos (Dixon S, 1982), por lo que no se acepta como una indicación establecida, debiendo individualizarse la decisión en función de las características del paciente y la experiencia del cirujano.
Pacientes con elevado riesgo quirúrgico [Ver Tabla Criterios exclusión Nascet inclusión Sapphire, jpg]: En este apartado se incluyen habitualmente aquellos pacientes que cumplen los criterios de exclusión del estudio NASCET o los que se propusieron como criterios de inclusión para el tratamiento mediante stents carotídeos en el estudio SAPPHIRE (Yadav JS, 2004). Sin embargo, dados los buenos resultados de las series quirúrgicas contemporáneas (Kang JL, 2009; Mozes G, 2004) y a la vista de los estudios comparativos entre las dos técnicas, que no han demostrado la superioridad del stent en este tipo de pacientes (SPACE Collaborative Group, 2006; Eckstein HH, 2008; Mas JL, 2008; Gurm HS, 2008), debemos considerar la EAC como la primera opción en este subgrupo de enfermos, con la excepción de aquellos que presentan factores de riesgo anatómicos para la cirugía. Definitivamente, la EAC mejora los resultados del stentig carotídeo en pacientes mayores de 80 años, por lo que debe ofrecerse como tratamiento de elección para este tipo de pacientes (Hobson RW, 2004).
Tabla Criterios exclusión Nascet inclusión Sapphire.
TÉCNICA
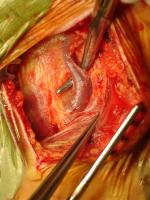
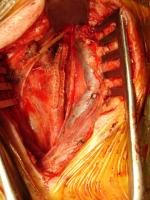
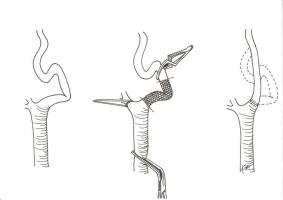
El paciente se coloca en decúbito supino con la cabecera de la mesa flexionada 10-20º en antitrendelemburg y el cuello moderadamente hiperextendido, pudiendo situarse una sábana plegada bajo los hombros. Se realiza una incisión cutánea paralela al borde anterior del músculo esternocleidomastoideo a lo largo de una línea que une la apófisis mastoides con la unión esternoclavicular, variando su extensión dependiendo de la posición de la bifurcación carotídea. Como alternativa puede realizarse una incisión oblicua siguiendo las líneas cutáneas del cuello. Posteriormente se profundiza a través del músculo platisma y el plano fascial hasta exponer la vena yugular interna y la vena facial primitiva, que actúa como referencia constante de la bifuración carotídea. [Figura 1. JPEG]. Esta vena se liga y se divide, permitiendo retraer la vena yugular interna lateralmente e identificar la bifurcación carotídea. En este punto se controla la arteria carótida común rodeándola con una cinta de silicona, teniendo la precaución de no lesionar el nervio vago, que suele ocupar la parte posterior de la vaina carotídea. Tras esta maniobra, se diseca la bifurcación carotídea evitando su excesiva manipulación para no desprender material trombótico procedente de la placa ateromatosa que puede causar una embolización cerebral e ICTUS, y al mismo tiempo prevenir un bradicardia sinusal por la estimulación del seno carotídeo (algunos cirujanos anestesian el seno carotídeo de forma sistemática para evitar este fenómeno). Por último se movilizan la arteria carótida externa, la arteria tiroidea superior y la carótida interna cranealmente hasta una zona no dañada por la aterosclerosis [Figura 2. JPEG], para ello, en ocasiones puede ser necesaria la división del vientre posterior del músculo digástrico. Durante el control distal de la arteria carótida interna es esencial identificar el nervio hipogloso, que cruza oblicuamente la parte superior del campo, evitando dañarlo.
Figura 1.
Figura 2.
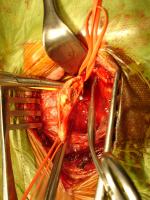
Tras el control de los vasos carotídeos se administra un bolo de heparina sódica intravenosa a dosis de 1 mg por kg de peso. Se procede al clampaje de los vasos carotídeos y se practica una arteriotomía longitudinal desde la carótida común hasta la carótida interna extendiéndola lo suficiente para permitir la evacuación de la íntima dañada. En este momento se puede insertar una derivación (shunt) para minimizar la isquemia cerebral durante el clampaje. A continuación se procede a la endarterectomía de la lesión entre la íntima y las capas circulares de la media de la pared arterial, se irriga con suero salino heparinizado y se retiran cuidadosamente los detritos [Figura 3. JPEG].
Figura 3.
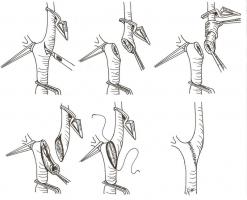
Si se visualiza un borde flotante libre de la íntima a nivel de la carótida interna debe fijarse mediante suturas de polipropileno. Terminada la endarterectomía, se cierra la arteriotomía, pudiendo utilizarse una sutura directa o un parche venoso o protésico. [Figura 4. JPEG]. La recomendación actual es que debe utilizarse sistemáticamente el cierre con parche, ya que reduce la incidencia de ICTUS perioperatorio y las reestenosis con independencia del material utilizado (Bond R, 2004). Por último se puede verificar el resultado técnico mediante angiografía o eco-doppler intraoperatorio, corrigiendo los defectos que puedan aparecer (fundamentalmente colgajos intimales en la carótida interna) para prevenir las complicaciones tromboembólicas y las reestenosis. El realizar esta comprobación final de forma rutinaria no modifica la tasa de ICTUS ipsilateral o de ICTUS/muerte, por lo que parece razonable su uso selectivo en función de los aspectos técnicos de la cirugía y la experiencia del cirujano (Rockman CB, 2007). Finalmente se revierte el efecto de la heparina mediante sulfato de protamina y se procede al cierre de la incisión, dejando un drenaje conectado a vacío a fin de evitar el colapso de la vía aérea en caso de que se produzca un hematoma cervical por sangrado en el postoperatorio inmediato.
Figura 4.
- Variantes técnicas.
Anestesia locorregional (bloqueo cervical): Permite evaluar la tolerancia del paciente al clampaje carotídeo realizando una exploración neurológica intraoperatoria y disminuye la tasa de eventos cardiológicos perioperatorios, por lo que es la técnica más ventajosa en pacientes que presentan comorbilidad de origen cardíaco. No modifica los resultados de la EAC en cuanto a mortalidad ni tasa de ICTUS, y su principal inconveniente es la ansiedad del paciente durante la intervención (Rerkasem K, 2008; Stoner MC, 2006).
Anestesia general: Ofrece un mejor control de la vía aérea, evita la ansiedad del paciente, y los anestésicos halogenados aumentan el flujo y disminuyen la demanda metabólica cerebral, mejorando la tolerancia al clampaje. La principal desventaja es que no permite valorar el estado neurológico del paciente durante la cirugía, por lo que se han empleado múltiples técnicas para tratar de detectar un flujo sanguíneo colateral insuficiente en el hemisferio ipsilateral a la carótida intervenida, como la determinación de la presión retrógrada de la carótida interna, la monitorización electroencefalográfica, el uso del doppler transcraneal, la oximetría cerebral, etc. (Pugliese F, 2009; Stoughton 1998; Hunter GC, 1982). Los datos obtenidos con estos métodos se han propuesto como indicadores para el uso selectivo de una derivación (shunt) durante la operación (ver siguiente apartado).
Derivación (shunt): Permite la irrigación cerebral continua mientras se realiza la endarterectomía, por lo que hay cirujanos que defienden su uso rutinario. Sin embargo, esto no disminuye la morbilidad neurológica, y la inserción incorrecta de la derivación puede producir complicaciones hasta en el 5% de los casos, como embolización distal de gas o restos trombóticos y desgarro de la íntima distal, que pueden originar ICTUS perioperatorios (Moore WS 1969; Bond R, 2002). Por todo ello, en muchos centros se prefiere su uso selectivo, basándose en la tolerancia al clampaje si el paciente está despierto, o en alguno de los test disponibles si se utiliza la anestesia general.
EAC por eversión: La endarterectomía por eversión se realiza mediante la sección completa y transversal del bulbo carotídeo, extracción de las placas de ateroma a través del plano de clivaje entre la íntima y la media de manera circunferencial, realizando eversión de los segmentos de la túnica media y de la adventicia de la arteria nativa, primero hacia la carótida común y después hacia la externa e interna respectivamente con cierre primario circunferencial término-terminal (Hernández, 2007) [Figura 5. Endarterectomía por eversión. JPEG]. La endarterectomía por eversión se propone como alternativa a la técnica clásica con resultados equiparables en cuanto a ICTUS/muerte perioperatorios y reestenosis (Byrne J, 2007; Cao P, 2000a; Cao P 2000b). Ofrece ventajas cuando hay necesidad de reimplantar una carótida interna redundante [Figura 6. JPEG]. Puede complicar la intervención en el caso de progresión distal de la placa en la carótida interna o cuando hay necesidad de insertar una derivación (Darling III RC, 2004).
Figura 5. Endarterectomía por eversión.
Figura 6. Reimplante de carótida interna redundante.
RESULTADOS
Todos los estudios citados a continuación constituyen la base para las indicaciones actuales de la EAC y se realizaron comparando dicha técnica con el tratamiento farmacológico de forma prospectiva y aleatorizada. El uso de la EAC está apoyado además por multitud de evidencias acumuladas en series de casos, estudios retrospectivos y revisiones sistemáticas (Hertzer NR, 1997; Hertzer NR, 1986a; Hertzer, 1986b; Biller J, 1998).
- Sintomáticos.
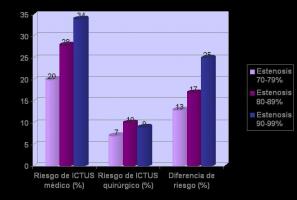
NASCET (NASCET Collaborators, 1991): Se estratificó a los pacientes según el grado de estenosis carotídea (del 30% al 69% o del 69% al 99%), valorado mediante arteriografía calculando el cociente entre el diámetro a nivel de la lesión y el diámetro de la arteria carótida interna distal (método NASCET). Las tasas de ICTUS/muerte en los 30 primeros días fueron del 2.1% en el grupo quirúrgico y el 0.9% entre los que recibieron tratamiento médico. El riesgo acumulado de ICTUS ipsilateral fue del 9% en el grupo quirúrgico y del 26% en el conservador, lo que supone un descenso absoluto del riesgo del 17%. El grado de estenosis se correlacionó con el riesgo de ICTUS, con mayor beneficio en el grupo quirúrgico para las estenosis del 69% al 99%, precisándose 6 EACs para prevenir 1 ICTUS a 2 años. En las estenosis del 50% al 69% el beneficio de la EAC fue menor (disminución del riesgo absoluto para cualquier ICTUS del 6.5% a 5 años), siendo necesario operar a 15 pacientes para evitar 1 ICTUS a 5 años. En las estenosis menores del 50% no se encontraron ventajas sobre el tratamiento médico. El beneficio también fue menor en las mujeres y en los ataques neurológicos transitorios con ceguera monocular transitoria (amaurosis fugax). [Figura 7. JPEG].
Figura 7.
ECST (Warlow C, 1991): El riesgo de ICTUS/muerte a 3 años llegó al 12.3% en el grupo quirúrgico frente a un 21.9% en el conservador cuando la estenosis era del 70% al 99%, con una tasa de morbimortalidad a los 30 días de un 7.5% en los pacientes operados. Por lo tanto se necesitarían 9 endarterectomías para evitar 1 ICTUS a 3 años.
El análisis de los datos agrupados de ambos estudios reveló que los beneficios de la cirugía decrecen si la intervención se retrasa más de 2 semanas desde la aparición de los primeros síntomas, elevando el número de EACs necesarias para evitar un ICTUS a cinco años de 5 si se interviene en las primeras 2 semanas a 125 si la cirugía se realiza pasadas 12 semanas (Rothwell PM, 2004). Estos datos generaron un debate entre los que propugnaban que la EAC temprana aumentaba la morbimortalidad perioperatoria (Rockman CB, 2006) y aquellos que defendían que no producía mayores tasas de ICTUS/muerte en los primeros 30 días tras la intervención en pacientes con un ataque neurológico transitorio o ICTUS menor reciente (Bond R, 2003). Los mismos datos demostraron que el ICTUS en evolución o los ataques neurológicos transitorios “in crescendo” se asociaban con un riesgo de ICTUS y muerte del 20.2% y el 11.4% respectivamente cuando se operaban de forma temprana. En este momento la recomendación general es operar en los primeros 14 días tras un AIT o ICTUS menor (Ballotta E, 2008), incluso se ha propuesto el tratar estos eventos como una urgencia, realizando una EAC en las primeras 48 horas (The National Stroke Strategy, www.dh.gov.uk/stroke).
- Asintomáticos.
ACAS (Executive Committee for the Asymptomatic Carotid Atherosclerosis Study, 1995): Se excluyeron las estenosis menores del 60%, resultando una tasa de ICTUS/muerte en los primeros 30 días del 2.3% en el grupo de la EAC frente a un 0.4% en el grupo de tratamiento médico, el riesgo estimado de ICTUS/muerte a los 5 años fue del 5.1% y del 11% respectivamente. Con estos datos, se precisarían 19 EACs para evitar 1 ICTUS a 5 años. La reducción del riesgo a 5 años fue menor en mujeres debido a una mayor morbilidad perioperatoria (3.6% frente a 1.7% en hombres).
ACST (Halliday A, 2004): Se estudiaron estenosis mayores del 60%, presentando una tasa de ICTUS/muerte a 30 días del 3.1% en el grupo quirúrgico, lo que se traducía en un riesgo de ICTUS/muerte a 5 años del 6.4% frente a un 11.8% en los tratados farmacológicamente. El beneficio fue menor en mujeres y en mayores de 75 años.
Un metanálsis del tratamiento de la estenosis carotídea no observa disminución del riesgo de ictus o muerte en los pacientes con estenosis carotídea asintomática con respecto al tratamiento médico (Guay J et al 2012).
- Complicaciones.
La complicación mas frecuente es la aparición de hematomas cervicales, que rara vez requieren evacuación quirúrgica. Las lesiones de los nervios craneales, cuya incidencia varía de un 3.8% a un 11% según las series, pueden afectar a los pares VII (fundamentalmente a su rama mandibular), IX, X, XI, XII y a las ramas cutáneas del plexo braquial. Normalmente producen un déficit transitorio que se resuelve en 4-6 semanas, aunque ocasionalmente se ocasiona un daño permanente (Conners III MS, 2004).
CONCLUSIONES
Visto lo anteriormente expuesto, podemos decir que la EAC continúa siendo el “gold standard” en el tratamiento de la estenosis carotídea y por ello sigue recomendándose con el máximo nivel de evidencia científica en las guías actuales. La EAC es superior al tratamiento médico en pacientes sintomáticos con estenosis carotídea mayor del 50% si podemos realizarla con una morbimortalidad a 30 días menor del 6%, con una reducción del riesgo absoluto de ICTUS del 16% a 5 años (Olsen TS, 2003; Liapis CD 2009). Los pacientes sintomáticos con estenosis menor del 50% y aquellos con estenosis preoclusivas (>99%) no se benefician de la cirugía (Rothwell PM, 2003). La EAC reduce el riesgo relativo de ICTUS un 30% a 5 años con respecto al tratamiento médico en pacientes asintomáticos con estenosis mayor del 60% si el riesgo quirúrgico es menor del 3% y la esperanza de vida mayor de 5 años (Hobson RW 2008). Siempre debe asociarse al tratamiento médico, que en la actualidad debe incluir fármacos antiagregantes plaquetarios, estatinas, y un control estricto de las cifras tensionales. Debemos tener en cuenta que el retraso en la intervención más allá de dos semanas en los pacientes sintomáticos reduce los beneficios a largo plazo del tratamiento quirúrgico. Otro factor a tener en cuenta es el sexo femenino, que aumentó las complicaciones en los estudios citados.
Por supuesto, el debate sobre cual es el mejor tratamiento para esta patología continúa abierto. Hay algunas preguntas pendientes de recibir respuesta, por ejemplo, si los avances en el tratamiento médico modificarán el manejo actual, y sobre todo, el papel que jugarán en el futuro las técnicas endovasculares. Para responder a estas cuestiones se han puesto en marcha nuevos estudios comparativos como el ACST-2 (Rudarakanchana N, 2009) y en breve tendremos nuevas evidencias procedentes de la publicación de los resultados del estudio CREST (Forbes TL, 2010). Sin embargo, las más recientes evidencias sobre el uso de stents carotídeos (Roffi M, 2009, Brown MM, 2009) sitúan a esta técnica por debajo de la EAC en cuanto a eventos neurológicos en los primeros 30 días tras el tratamiento. Por tanto, a la espera de nuevos avances, y como viene ocurriendo desde hace seis décadas, parece que la EAC continuará siendo un arma de primera línea en la prevención del ICTUS isquémico asociado a la estenosis carotídea.
BIBLIOGRAFÍA
• Ballotta E, Meneghetti G, Da Giau G, Manara R, Saladini M, Baracchini C, (2008). Carotid endarterectomy within 2 weeks of minor ischemic stroke: A prospective study. J Vasc Surg; 48:595-600.
• Biller J, Feinberg WM, Castaldo JE, Whittemore AD, Harbaugh RE, Dempsey RJ, et al (1998). Guidelines for carotid endarterectomy: a statement for healthcare professionals from a Special Writing Group of the Stroke Council, American Heart Association. Circulation; 97: 501-509.
• Bond R, Rerkasem K, Rothwell PM (2002). Derivación (shunt) sistemática o selectiva de la arteria carótida para la endarterectomía carotídea (y otros métodos de control en la derivación selectiva). Cochrane Database of Systematic Reviews; Issue 2. Art. No.: CD00190.
• Bond R, Rerkasem K, Rothwell PM (2003). Systematic Review of the Risks of Carotid Endarterectomy in Relation to the Clinical Indication for and Timing of Surgery. Stroke; 2003: 2290-2303.
• Bond R, Rerkasem K, AbuRahma AF, Naylor AR, Rothwell PM (2004). Angioplastia con parche versus cierre primario para la endarterectomía carotídea. Cochrane Database of Systematic Reviews; Issue 2. Art. No.: CD000160.
• Bonita R (1992). Epidemiology of stroke. Lancet; 339: 342-344.
• Brown MM, Ederle J, Bonati LH. Early results of the International Carotid Stenting Study: outcome of patients randomised between carotid stenting and endarterectomy for symptomatic carotid stenosis. European Stroke Conference 2009. Stocklom, Sweden.
• Byrne J, Feustel P, Darling III RC (2007). Primary Closure, Routine Patching, and Eversion Endarterectomy: What is the Current State of the Literature Supporting Use of These Techniques? Semin Vasc Surg; 20: 226-235.
• Cao P, De Rango P, Zannetti S, Giordano G, Ricci S, Celani MG (2000a) Eversion versus conventional carotid endarterectomy for preventing stroke. Cochrane Database of Systematic Reviews; Issue 4. Art. No.: CD001921.
• Cao P, Giordano G, De Rango P, Zannetti S, Chiesa R, Coppi G, et al (2000b). Eversion versus conventional carotid endarterectomy: Late results of a prospective multicenter randomized trial. J Vasc Surg; 31: 19-30.
• Conners III MS, Money SR (2004). En: Blakwell Publishing. Haimovici´s Vascular Surgery 5th Edition (817-826).
• Darling III RC, Mehta M, Paty PS, Ozsvath KJ, Roddy SP, Kreienberg PB, et al (2004). En: Blakwell Publishing. Haimovici´s Vascular Surgery 5th Edition (810-816).
• Dixon S, Pais SO, Raviola C, Gomes A, Machleder HI, Baker JD, et al (1982). Natural history of nonstenotic, asymptomatic ulcerative lesions of the carotid artery. A further analysis. Arch Surg; 117: 1493-1498.
• Eascott HH, Pickerinig RW, Rob CG (1954). Reconstruction of internal carotid artery in a patient with intermittent attacks of hemiplegia. Lancet; 267: 994-996.
• Eckstein HH, Ringleb P, Allemberg JR, Berger J, Fraedrich G, Hacke W, et al (2008). Results of the Stent-Protected Angioplasty versus Carotid Endarterectomy (SPACE) study to treat symptomatic stenoses at 2 years: a multinational, prospective, randomised trial. Lancet Neurol; 10: 893-902.
• Executive Committee for the Asymptomatic Carotid Atherosclerosis Study (1995). Endarterectomy for Asymptomatic Carotid Artery Stenosis. JAMA; 273; 1421-1428.
• Forbes TL (2010). Preliminary results of carotid revascularization endarterectomy vs stenting trial (CREST). J Vasc Surg; 51: 1300-1301.
• Goldstein LB, Adams R, Becker K, Furberg CD, Gorelick PB, Hademenos G, et al (2001). Primary Prevention of Ischemic Stroke : A Statement for Healthcare Professionals From the Stroke Council of the American Heart Association. Stroke; 32: 280-299.
• Goldstein LB, Adams R, Alberts MJ, Appel LJ, Brass LM, Bushnell CD, et al (2006). Primary Prevention of Ischemic Stroke. Circulation; 113: e873-e923.
Guay J, Ochroch EA (2012). Carotid Endarterectomy Plus Medical Therapy or Medical Therapy Alone for Carotid Artery Stenosis in Symptomatic or Asymptomatic Patients: A Meta-Analysis. Journal of cardiothoracic and vascular anesthesia. Apr 9
• Gurm HS, Yadav JS, Fayad P, Katzen BT, Mishkel GJ, Bajwa TK (2008). Long-term results of carotid stenting versus endarterectomy in high-risk patients. N Engl J Med; 358: 1572-1579.
• Halliday A, Mansfield A, Marro J, Peto C, Peto R, Potter J, et al, (2004). Prevention of disabling and fatal strokes by successful carotid endarterectomy in patients without recent neurological symptoms: randomised controlled trial. Lancet; 363: 1491-1502.
• Hernández SearaI Alejandro et al. Endarterectomía carotídea por eversión. Estudio comparativo con la técnica convencional. 2007.
• Hertzer NR, Flanagan RA Jr, Beven EG, O'Hara PJ (1986a). Surgical versus nonoperative treatment of symptomatic carotid stenosis. 211 patients documented by intravenous angiography. Ann Surg; 204: 154-162.
• Hertzer NR, Flanagan RA Jr, Beven EG, O'Hara PJ (1986b). Surgical versus nonoperative treatment of asymptomatic carotid stenosis. 290 patients documented by intravenous angiography. Ann Surg; 204: 163-171.
• Hertzer NR, O´Hara PJ, Mascha EJ, Krajewski LP, Sullivan TM, Beven EG (1997). Early outcome assessment for 2228 consecutive carotid endarterectomy procedures: The Cleveland Clinic experience from 1989 to 1995. J Vasc Surg; 26: 1-10.
• Hobson RW, Howard VJ, Roubin GS, Brott TG, Ferguson RD, Popma JJ, et al (2004). Carotid artery stenting is associated with increased complications in octogenarians: 30-day stroke and death rates in the CREST lead-in phase. J Vasc Surg; 40: 1106-1111.
• Hobson RW, Mackey WC, Ascher E, Murad MH, Calligaro KD, Comerota AJ, et al (2008). Management of atherosclerotic carotid artery disease: clinical practice guidelines of the Society for Vascular Surgery. J Vasc Surg; 48: 480-486.
• Hunter GC, Sieffert G, Malone JM, Moore WS (1982). The Accuracy of Carotid Back Pressure as an Index for Shunt Requirements: A Reappraisal. Stroke; 13: 319-326.
• Kang JL, Chung TK, Lancaster RT, LaMuraglia GM, Conrad MF, Cambria RP (2009). Outcomes after carotid endarterectomy: Is there a high-risk population? A National Surgical Quality Improvement Program report. J Vasc Surg; 49: 331-339.
• Krupski WC, Moore WS (2006). Indicaciones, técnica quirúrgica y resultados de la reparación de las lesiones oclusivas extracraneales. En: Elsevier. Rutherford Cirugía Vascular 6ª Edición (1975-2005).
• Liapis CD, Bell PR, Mikhailidis D, Sivenius J, Nicolaides A, Fernández e fernández J, et al (2009). ESVS guidelines. Invasive treatment for carotid stenosis: indications, techniques. Eur J Vasc Endovasc Surg; 37 (4 Suppl): 1-19.
• Makhoul RG, Moore WS, Colburn MD, Quiñones-Baldrich WJ, Vescera CL (1993). Benefit of carotid endarterectomy after prior stroke. J Vasc Surg; 18: 666-670.
• Mas JL, Trinquart L, Leys D, Albucher JF, Rousseau H, Viguier A, et al (2008). Endarterectomy Versus Angioplasty in Patients with Symptomatic Severe Carotid Stenosis (EVA-3S) trial: results up to 4 years from a randomised, multicentre trial. Lancet Neurol; 7: 885-892.
• Mentzer RM, Finkelmeier BA, Crosby IK, Wellons HA Jr. (1981). Emergency carotid endarterectomy for fluctuating neurologic deficits. Surgery ; 89: 60-66.
• Moore WS, Hall A (1969). Carotid artery back pressure: a test of cerebral tolerance to temporary carotid occlusion. Arch Surg; 99: 702-710.
• Mozes G, Sullivan TM, Torres-Russotto DR, Bower TC, Hoskin TL, Sampaio SM, et al (2004). Carotid endarterectomy in SAPPHIRE-eligible high-risk patients: Implications for selecting patients for carotid angioplasty and stenting. J Vasc Surg; 39: 958-966.
• NASCET Collaborators (1991). Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis. North American Symptomatic Carotid Endarterectomy Trial Collaborators. N Engl J Med; 325: 445-453.
• Norris JW, Zhu CZ, Bornstein NM, Chambers BR (1991). Vascular risks of asymptomatic carotid stenosis. Stroke; 22: 1485-1490.
• Olsen TS, Langhorne P, Diener HC, Hennerici M, Ferro J, Sivenius J, et al, (2003). European Stroke Initiative Recommendations for Stroke Management-update 2003. Cerebrovasc Dis; 16: 311-317.
• Pugliese F, Ruberto F, Tosi A, Martelli S, Bruno K, Summonti D, et al (2009). Regional cerebral saturation versus transcranial Doppler during carotid endarterectomy under regional anaesthesia. Eur J anestesiol; 26: 643-647.
• Rerkasem K, Rothwell PM (2008). Local versus general anaesthesia for carotid endarterectomy. Cochrane Database of Systematic Reviews; Issue 4. Art. No.: CD000126.
• Rockman CB, Maldonado TS, Jacobowitz GR, Cayne NS, PJ, Riles TS (2006). Early carotid endarterectomy in symptomatic patients is associated with poorer perioperative outcomes J Vasc Surg; 44: 480-487.
• Rockman CB, Halm EA (2007). Intraoperative Imaging: Does it Really Improve Perioperative Outcomes of Carotid Endarterectomy? Semin Vasc Surg; 20: 236-243.
• Roffi M, Mukherjee D, Clair DG (2009). Carotid artery stenting vs. endarterectomy. Eur Heart J; 30: 2693-2704.
• Rothwell PM, Eliasziw M, Gutnikow SA, Fox AJ, Taylor DW, Mayberg MR, et al (2003). Analysis of pooled data from the randomised controlled trials of endarterectomy for symptomatic carotid stenosis. Lancet; 361: 107-116.
• Rothwell PM, Eliasziw M, Gutnikov SA, Warlow CP, Barnett HJ (2004). Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery Lancet; 363:915-924.
• Rudarakanchana N, Dialynas M, Halliday A (2009). Asymptomatic Carotid Surgery Trial-2 (ACST-2): rationale for a randomised clinical trial comparing carotid endarterectomy with carotid artery stenting in patients with asymptomatic carotid artery stenosis. Eur J Vasc Endovasc Surg; 38: 239-242.
• Rudarakanchana N, Halliday A (2010). Why are long delays between symptoms and carotid surgery in the UK. En: BIBA publishing. Vascular and endovascular challenges update (10-16).
• Sacco RL, Wolf PA, Kannel WB, Mcnamara PM (1982). Survival and Recurrence Following Stroke. The Framingham Study. Stroke;13: 290-295.
• Sacco RL, Adams R, Albers G, Alberts MJ, Benavente O, Furie K, et al (2006). Guidelines for Prevention of Stroke in Patients With Ischemic Stroke or Transient Ischemic Attack. Stroke; 37: 577-617.
• SPACE Collaborative Group (2006). 30 day results from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial. Lancet; 368: 1239-1247.
• Stoner MC, Abbott WM, Wong DR, Hua HT, LaMuraglia GM, Kwolek CJ, et al (2006). Defining the high-risk patient for carotid endarterectomy: An analysis of the prospective National Surgical Quality Improvement Program database. J Vasc Surg; 43: 285-296.
• Stoughton J, Nath RL, Abbott WM (1998). Comparison of simultaneous electroencephalographic and mental status monitoring during carotid endarterectomy with regional anesthesia. J Vasc Surg; 28: 1014-1023.
• Sze PC, Reitman D, Pincus MM, Sacks HS, Chalmers TC (1998). Antiplatelet agents in the secondary prevention of stroke: meta- analysis of the randomized control trials. Stroke; 19: 436-442.
• The National Stroke Strategy, www.dh.gov.uk/stroke.
• Timstit SG, Sacco RL, Mohr JP, Foulkes MA, Tatemichi TK, Wolf PA, et al (1992). Early clinical differentiation of cerebral infarction from severe atherosclerotic stenosis and cardioembolism. Stroke; 23: 486-491.
• Warlow C (1991). MRC European Carotid Surgery Trial: interim results for symptomatic patients with severe (70-99%) or with mild (0-29%) carotid stenosis . Lancet; 337:1235-1243.
• Yadav S, Wholey MH, Kuntz RE, Fayad P, Katzen BT, Mishkel GJ, et al (2004). Protected Carotid-Artery Stenting versus Endarterectomy in High-Risk Patients. N Engl J Med; 351:1493-1501.
- 30878 lecturas