Síndrome Antifosfolípido
El síndrome antifosfolípido (SAF) se considera una enfermedad autoinmune caracterizado por eventos trombóticos recurrentes, abortos y trombocitopenia.
Puede ser primario si no se relaciona con ninguna otra enfermedad, y secundario si se asocia a otro proceso inmune (más frecuente el lupus), pero también pueden aparecer en relación con neoplasias o infecciones. (Conde A, 2010, Suárez-Luis I, 2003). Raramente es hereditario.
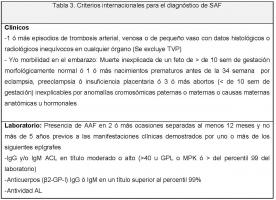
El SAF se caracteriza por la presencia en suero de al menos un tipo de anticuerpos antifosfolípido (AAF) y la ocurrencia de al menos una manifestación de una lista de potenciales manifestaciones, entre las que se incluyen como más frecuentes la trombosis venosa o arterial, abortos recurrentes o trombocitopenia. (Rodrigues C, 2010). (Ver Tabla 3. Criterios diagnósticos internacionales del SAF jpg)
Tabla 3. Criterios diagnósticos internacionales del SAF. Se considera SAF definido si al menos está presente uno de los criterios clínicos descritos y uno de los criterios de laboratorio.
La prevalencia de AAF en sujetos aparentemente sanos varía del 1-5% y aumenta con la edad, especialmente en ancianos con enfermedades crónicas. Se han descrito 3 tipos principales de AAF que son el anticoagulante lúpico (AL), anticuerpos anticardiolipina (ACL), y anticuerpos anti glicoproteína β2-I pero existen otros tipos menos estudiados como los anticuerpos antifosfatidilserina, antifosfatidiletanolamina, antifosfatidilinositol y antifosfatidilcolina cuyo significado clínico aún no está claro, pero que pueden ser positivos en pacientes con negatividad para los más típicos, hecho que puede ocurrir en pacientes con LES e ictus (Sanjay C, 2002).
El término anticoagulante lúpico puede dar lugar a confusiones porque la presencia de AL se suele asociar con una tendencia trombótica, no anticoagulante, hay más de un anticuerpo relacionado con la actividad AL. De hecho, tanto los anticuerpos anticardiolipina, y el de la glicoproteína β2-I pueden tener actividad LA. Sólo el 50% de los pacientes con un anticuerpo LA cumple los criterios del American College of Rheumatology para el diagnóstico de LES y la mayoría de los pacientes que no tienen LES en la presentación no lo desarrollan.
MANIFESTACIONES CLÍNICAS
Las manifestaciones más frecuentes del SAF (Cervera, 2009) son: la trombosis venosa profunda (38.9%), la trombocitopenia (29.6%), algunas neurológicas como el ictus (19.8%), el ataque isquémico transitorio (11.1%) y la epilepsia (7%) y otras menos frecuentes como la mielopatía, corea, cefalea, síndromes oculares y demencia. Además, puede producir embolia pulmonar (14.1%), anemia hemolítica (9.7%) y morbilidad obstétrica.
El ictus es la complicación más frecuente y grave de los pacientes con SAF. Parece que estos pacientes presentan una elevada morbilidad relacionada con el ictus. Se ha sugerido que más del 20% de los ictus en pacientes menores de 45 años están asociados con el SAF, en estos casos la prevalencia es más alta en mujeres (Terashi H, 2005). La oclusión arterial puede ser trombótica o embólica.
Las manifestaciones clínicas dependerán del territorio arterial afectado, que puede ser cerebral o medular. Aunque pueden afectar a arterias de gran y pequeño tamaño, los ictus suelen ser de pequeño tamaño. Las oclusiones arteriales múltiples, frecuentemente se asocian con afectación de arterias pequeñas y pueden contribuir a desarrollar una demencia vascular.
Conviene recordar una entidad poco frecuente y grave, que es “el síndrome antifosfolípido catastrófico” con elevada mortalidad, debida a microangiopatía con afectación renal, pulmonar, del SNC, cardíaca, cutánea e incluso CID.
DIAGNÓSTICO
El diagnóstico se basa en unos criterios de consenso internacional conocidos como de Sapporo (Kitagawa Y, 2008) que incluye datos clínicos y de laboratorio. Estos criterios se desarrollaron sobre todo con fines de investigación y han sido revisados en varias ocasiones. Pueden resultar útiles al clínico, pero no es imprescindible que se cumplan todos, para el diagnóstico clínico de SAF (Ver Tabla 3. Criterios internacionales para el diagnóstico de SAF jpg).
Dada la heterogeneidad de los anticuerpos en el SAF, las formas de detección y su significación son también variables.
Determinación de AL
Los AL se estudian con un test funcional que puede detectar la presencia de antifosfolípidos. La porción “anticoagulante” del término deriva de que el tiempo parcial de tromboplastina (aPTT) está prolongado en aproximadamente un 50% de los pacientes. En circunstancias raras, los pacientes con LA también pueden tener una prolongación del tiempo de protrombina. Su presencia es más específica pero menos sensible que la de los ACL
Determinación de ACL
Son anticuerpos capaces de reaccionar frente a la cardiolipina (componente de la membrana interna mitocondrial) pero también frente a otros fosfolípidos). El título es proporcional al riesgo de eventos trombóticos, teniendo un significado patológico un título medio-alto (> 40 unidades GLP). Títulos altos se correlacionan con la presencia de factores de riesgo vascular y su presencia, además modifica el colesterol LDL (Conde A, 2010, Kitagawa Y, 2008). La presencia de anticuerpos anticardiolipina se considera un factor de riesgo para el ictus, sin embargo, existe controversia sobre si la positividad de anticuerpos antifosfolípido en un primer ictus aumenta el riesgo de recurrencia en una población no seleccionada (Group APASS, 1997). En el estudio Framingham (Janardhan V, 2004), se señaló que altas concentraciones de anticuerpos anticardiolipina, independientemente de la presencia de otros factores de riesgo cerebrovascular, tenía un valor predictivo significativo de riesgo para un nuevo ictus y AIT en mujeres pero no en hombres. Varios estudios han comunicado la alta prevalencia de isquemia cerebral en niños con anticuerpos antifosfolípido, señalando que la prevalencia de marcadores trombofílicos especialmente el FVL, y de los anticuerpos antifosfolípido es más alta en niños que han tenido un ictus (Kenet G, 2000)
El test del VDRL desarrollado como un test para la sífilis, mide la aglutinación de partículas lipídicas que contienen colesterol y cardiolipina, un fosfolípido cargado negativamente. Los AF pueden unirse a la cardiolipina en estas partículas lipídicas y producir una aglutinación indistinguible de la observada en los pacientes con sífilis.
Los ACL también pueden aparecer en otras infecciones, ser inducidos por fármacos e incluso neoplasias, por lo que hay que descartar que su determinación corresponda a anticuerpos transitorios, con una segunda determinación a los 3 meses. Suele ser el anticuerpo AF que se detecta en población sana e independiente de la glicoproteína β2-GP-I.
Anticuerpos antiglicoproteína β2-I (β2-GP-I)
La β2-GP-I es la diana más frecuente de los AAF, esta proteína conocida también como apolipoproteína H, se hace antigénica al unirse a una superficie cargada negativamente. La importancia de esta característica es que los ELISAs anticardiolpina positivos con características clínicas de SAF son frecuentemente causadas por la unión de anticuerpos anti β2-GP-I. Los pacientes con ACL positivos pero con tests negativos para anticuerpos anti β2-GP-I pueden tener un riesgo menor o incluso ninguno para la formación de trombos, pero este aspecto está aún sin aclarar.
La correlación entre el ictus o el AIT y los niveles altos de ACL IgG o de AL ha quedado establecida en la literatura (Ruiz-Irastorza, 2009).
Neuroimagen:
En algunos pacientes con SAF, la RM craneal revela lesiones hiperintensas que son sugestivas de vasculopatía incluso aunque no haya datos clínicos de un ictus y puede plantear el diagnóstico diferencial con otras enfermedades de la sustancia blanca.
TRATAMIENTO
Existe gran controversia respecto al tratamiento de elección en los pacientes con ictus y SAF. El estudio, en cualquier caso, debe ser exhaustivo para descartar la existencia de otras patologías concomitantes.
En general se recomienda en el ictus criptogénico o el AIT en pacientes con AAF (ya cumple criterios para el diagnóstico de SAF) la warfarina, incluso en ausencia de otras manifestaciones del SAF, manteniendo unos niveles de INR de 2-3. En los ictus recurrentes a pesar de la anticoagulación se ha planteado asociar ácido acetilsalicílico.
En pacientes con SAF y que tienen lesiones en la RM hiperintensas, se recomienda antiagregación con aspirina y warfarina si a pesar de la aspirina aumentan las lesiones en la sustancia blanca o hay déficit cognitivos, habiéndose observado mejorías drásticas en algunos casos (Cuadrado MJ, 2001) pero esta recomendación no es universalmente aceptada.
BIBLIOGRAFÍA
Álvarez Sabin J, Rovira Cañellas A, Molina C, Serena J, Moltó JM (2006). Guía para la utilización de métodos y técnicas diagnósticas en el ictus. En: Díez Tejedor E (Ed), Guía para el diagnóstico y tratamiento del ictus (pp 25-63). Barcelona: Prous Science.
Bauer KA. (2001). The thrombophilias: well-defined risk factors with uncertain therapeutic implications. Ann Intern Med. 135: 367.
Bauer KA. Management of inherited thrombophilia. Acceso el 13 de julio de 2010. http://www.uptodate.com/online/content/thrombophilia.
Bushnell CD, Goldstein LB (2002). Physician knowledge and practices in the evaluation of coagulopathies in stroke patients. Stroke. 33: 948-953.
Cervera R, Boffa M-C, Khamastha MA, Hughes GRU. (2009). The Euro-Phospholipid project epidemiology of the antiphospholipid syndrome in Europe. Lupus. 18: 889-93.
Conde A, Aristin J, Gómez JC. (2010). Ictus, lupus eritematoso sistémico y síndrome antifosfolípido. Revista del grupo de estudio de enfermedades cerebrovasculares de la Sociedad Española de Neurología. Patología vascular infrecuente del sistema nervioso central. 7: 20-25.
Cuadrado MJ, Khamashta MA. (2001). Migraine in Hughes syndrome. Heparin as a therapeutic trial?. Q J Med; 94: 114-5
Emmerich J, Rosendaal FR, Cattaneo M, Margaglione M, De Stefano V, Cumming T, et al. (2001) Combined effect of factor V Leiden and prothrombin 20210A on the risk of venous thromboembolism--pooled analysis of 8 case-control studies including 2310 cases and 3204 controls. Study Group for Pooled-Analysis in Venous Thromboembolism.. Thromb Haemost. 86(3):809-16. Erratum in: Thromb Haemost 2001 Dec; 86(6):1598.
Fields Madeline C, Levine SR. (2005) Thrombophilias and Stroke: Diagnosis, Treatment and Prognosis. Journal of Thrombosis and Thrombolysis; 20 113-126:
Furie K, Kelly PJ, Kistler JP. (2004). Coagulation studies. In; Chaturverdi SR, Levine SR (eds), Transient Ischemic Attacks. Blackwell Futurs Publishing: 214-231.
Gillum LA, Mamidipudi SK, Johnston SC. (2000) Ischemic stroke risk with oral contraceptives: a metaanalysis. JAMA. 284:72-78.
Gómez EB, van Goor MP, Leebeek FW, Brouwers GJ, Koudstaal PJ, Dippel DW. (2002). Elevated prothrombin is a risk factor for cerebral arterial ischemia in young adults. Clin Neurol Neurosurg. 104:285-288.
Group APASS. (1997). Anticardiolipin antibodies and the risk of recurrent thrombo-occlusive events and death. Neurology. 48: 91-4
Heijmans BT, Westendrop RG, Knoop DL et al. (1998). The risk of mortality and the factor V Leiden mutation in a population-based cohort. Thromb Haemost 80: 607.
Hindorff LA, Schwartz SM, Siscovick DS, Psaty BM, Longstreth WT Jr, Reiner AP. (2002). The association of PAI-1 promotor 4G/5G insertion/deletion polymorphism with myocardial infarction and stroke in young women. Cardiovasc Risk; 9: 131-137.
Janardhan V, Wolf PA, Kaser CS, Massaro JM, D´Agostino RB, Franzblau C et al. (2004). Anticardiolipin antibodies and risk of ischemic stroke and transient ischemic attack: the Framingham cohort and offspring study. Stroke. 33: 2396-400.
Jungehulsing GJ, Nolte CH. (2008). Prothrombotic gene variations in ischemic stroke: no difference between large and small vessel disease?. Neuroepidemiology; 31:282.
Kitagawa Y, Ohkuma H, Tokuoka K (2008). Ischemic stroke with antiphospholipid antibody. Brain Nerve; 60: 1144-58.
Kenet G, Lütkhoff L, Albisetti M, Bernard T, Bonduel M, Brandao L. (2010). Impact of Thrombophilia on risk of arterial ischemic stroke or cerebral sinovenous thrombosis in neonates and children. Circulation; 121: 1838-1847.
Kenet G, Sadetzki S, Murad H, Martinowitz U, Rosenberg N, Gitel S et al. (2000). Factor V Leiden and antiphospholipid antibodies are significant risk factors for ischemic stroke in children. Stroke. 31: 1283-8.
MacClellan LR, Mitchell BD, Cole JW, et al (2006). Familial aggregation of ischemic stroke in young women: the Stroke Prevention in Young Women Study. Genet Epidemiol. 30:602-608.
Mateo J, Oliver A, Borrell M (1997). Laboratory evaluation and clinical characteristics of 2132 consecutive unselected patients with venous thromboembolism-results of the Spanish Multicentric Study on Thrombophilia (EMET-study). Thromb Haemost 77:444.
Pezzini A, Grassi M, Iacoviello L. (2007) Inherited thrombophilia and stratification of ischaemic stroke risk among users of oral contraceptives. J Neurol Neurosurg Psychiatry; 78:271-276.
Pruissen MO, Slooter A, Rosendaal FR, Van der Graaf Y and Algra A (2008). Coagulation factor XIII gene variation, oral contraceptives, and risk of ischemic stroke. Blood. 111:1282-1286
Reed DC, Cox M, Clegg JB. (1995) World distribution of Factor V Leiden, Lancet 369: 64-67.
Rodrigues C, Carvalho JF, Shoenfeld Y. (2010). Neurological manifestations of antiphospholipid síndrome. Eur J Clin Invest; 40: 350-359.
Ruiz-Irastorza G, Martínez-Berriotxoa A, Egurbide MV. (2009). The antiphospholipid syndrome in the 21st Century. Med Clin (Barc): 133-136.
Sanjay C, Keswani N (2002). Antiphospholipid syndrome. Review article. Journal of the Royal Society of Medicine; 95.
Suárez-Luis I, Rodríguez-Rodríguez Y, Roussó-Viota T, Cordero-Eiriz A. (2003). Algunas consideraciones acerca de los posibles mecanismos patológicos en el síndrome antifosfolípido e ictus. Rev Neurol. 37: 654-657.
Terashi H, Uchiyama S, Hashimoto S, Miyazaki K, Tsutsumi Y, Yamazaki M et al. (2005). Clinical characteristics of stroke patients with antiphospholipid antibodies. Cerebrovasc Dis. 19: 384-90.
- 38933 lecturas