Ictus Cardioembólico
“Defining and diagnosing cerebral embolism has proven as difficult as capturing an attractive but elusive Butterfly” (Caplan et al, 1983)
INTRODUCCIÓN
Un ictus cardioembólico es el que se produce como consecuencia de la oclusión de una arteria cerebral por un trombo que proviene del corazón. Hay otros embolismos que comparten con los de origen cardiaco la forma de presentación clínica y la distribución lesional, pero su manejo es distinto. Esas otras fuentes de émbolos (Castillo et al, 1997) son las propias arterias, entre ellas la aorta, el sistema venoso (embolismos paradójicos), para lo cual es necesario que exista un cortocircuito, sea en el propio corazón o a nivel pulmonar, y las que liberan o introducen en el árbol arterial otros materiales tales como aire, grasa, o agregados celulares neoplásicos. Algunos de estos embolismos de origen no cardiaco se abordan específicamente en otros capítulos de Neurowikia; en este nos ceñiremos a aquellos en lo que el émbolo procede del propio corazón. La TABLA I recoge las fuentes posibles de embolismo cerebral.
CONCEPTO
Según la Guía del Grupo de Estudio de Enfermedades Cerebrovassculares de la Sociedad Española de Neurología (Arboix et al, 2006), el infarto cardioembólico se define como un “infarto generalmente de tamaño medio (1’5 a 3 cm) o grande (> 3 cm), de topografía cortical, con inicio de los síntomas en vigilia, presentación instantánea (en minutos) o aguda (en horas) de la focalidad neurológica y máximo déficit neurológico en las primeras horas de la enfermedad. Es imprescindible la presencia de una cardiopatía embolígena demostrada y la ausencia de oclusión o estenosis arterial significativa de forma concomitante”. Sin embargo, en la práctica, el embolismo cerebral es un proceso dinámico en el que son variables el origen y la composición de los émbolos, el momento y forma de paso al torrente sanguíneo, su alojamiento en una arteria cerebral y su eventual disgregación, con lo que las características clínicas de los embolismos cerebrales en general, y cardioembolismos en particular, pueden diferir de esos patrones clásicos (Caplan et al, 1983; Caplan, 1991).
PATOLOGÍA
El material embólico procedente del corazón está constituido principalmente por fibrina y plaquetas, -trombos “rojos”, “blancos” o mixtos-, pero también pueden estar formado por fragmentos de vegetaciones sépticas o asépticas, material cálcico o fibromixoide procedentes de válvulas degeneradas, o células tumorales de mixomas. (Castillo et al, 1997). Como se ha dicho, el ictus embólico se define anatómicamente por la existencia de un infarto cerebral territorial mediano o grande, habitualmente con componente cortical; es frecuente el aspecto parcheado en un territorio arterial (“patrón territorial fragmentado”) y es muy sugerente que se produzcan infartos simultáneos o próximos en el tiempo en distintos territorios, o que el ictus se asocie a un embolismo periférico. Una distribución característica y frecuente es la que afecta al territorio profundo de la arteria cerebral media, asociada a infartos corticales, porque la oclusión transitoria del segmento M1 da lugar a infarto en el territorio de las arterias lentículo-estriadas, y posteriormente hay una migración distal de fragmentos del trombo disgregado hacia ramas corticales (Ribó, 2008). Los infartos embólicos tienen tendencia a la trasformación hemorrágica por reperfusión. (Furie et al, 2004). En las FIGURAS 1 a 7 exponen imágenes de distintos casos de infartos cerebrales embólicos.
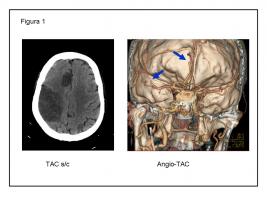
FIGURA 1.- Mujer. 77 años. FA no conocida previamente. Oclusión de tronco superior de M2 de ACMD y de A2 de ACAD (flechas), con infarto simultaneo en ambos territorios.
FA: fibrilación auricular. ACMD: arteria cerebral media derecha. ACAD: arteria cerebral anterior derecha.
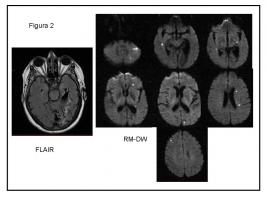
FIGURA 2.- Mujer, 71 años. HTA, DM. Ictus en territorio de ACPI 6 años antes. Crisis parciales simples sensitivas. Múltiples imágenes puntiformes hiperintensas en RM DW. Embolismos de probable origen aórtico.
DM: diabetes mellitus. ACPI: arteria cerebral posterior izquierda. RM DW: secuencias en resonancia de difusión.
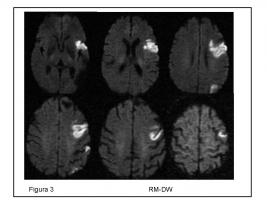
FIGURA 3.- Hombre, 60 años. Tabaquismo. Ictus previo de causa no filiada. Infarto ACMI con “patrón territorial fragmentado”. Embolismo criptogénico.
ACMI: arteria cerebral media izquierda.
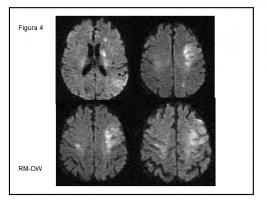
FIGURA 4.- Hombre, 51 años. Ingresa afásico, sin posibilidad de anamnesis. Infartos dispersos en territorio de ACMI y lesión simultánea cortical contralateral. No se encontró fuente de émbolos.
ACMI: arteria cerebral media izquierda.
EPIDEMIOLOGÍA
El ictus cardioembólico constituye entre un cuarto y un tercio de todos los ictus isquémicos (Castillo et al, 1997; Ribó, 2008), según los distintos registros y según la mayor o menor laxitud de los criterios que se utilicen para su clasificación. Intuimos que algunos ictus indeterminados son ictus embólicos en los que no se ha conseguido encontrar la fuente del émbolo; la clasificación SSS-TOAST incluye la categoría de embolismo criptogénico para esos casos (Ay et al, 2005). Desde el punto de vista pronóstico son, como grupo, más severos que aterotrombóticos y lacunares.
CLÍNICA
Todos los infartos embólicos comparten la brusquedad de su instauración y la característica de que el déficit es mas intenso en el momento del debut. No hay, sin embargo, ningún rasgo que permita suponer el origen del material embólico, por lo que el diagnóstico de cardioembolismo se sigue basando en el hallazgo de una fuente cardiaca de émbolos, y en la exclusión de causas concomitantes del ictus. No está aún a nuestro alcance la identificación y análisis del émbolo en sí, que solo podemos intuir si encontramos su origen; “hemos de identificar los pájaros a partir de sus nidos”, (Caplan, 1991). Los ictus cardioembólicos están precedidos por AIT (ataques isquémicos transitorios) con menos frecuencia que los aterotrombóticos y lacunares.
Las manifestaciones dependen obviamente de la arteria ocluida, con mayor frecuencia la ACM (arteria cerebral media) y sus ramas en territorio carotídeo y la ACP (arteria cerebral posterior), la PICA (arteria cerebelosa posteroinferior) y la basilar en el territorio posterior, siendo por tanto los síndrome clínicos más frecuentes un síndrome parcial o total de ACM, usualmente con componente cortical (hemiparesia, paresia facial central, alteración campimétrica, alteraciones sensitivas ipsilaterales, y afasia si ocurre en el hemisferio dominante o heminegligencia si es en hemisferio derecho, aislados o en combinación), una hemianopsia aislada, un síndrome de Wallemberg, un síndrome protuberancial o mesencefálico, o un síndrome del “top de la basilar” (Caplan et al, 1983; Furie et al, 2004; Ribó, 2008). La Tabla II recoge las características clínicas clásicas de los ictus cardioembólicos, así como sus características más comunes en la neuroimagen.
DIAGNÓSTICO
Tras una clínica sugerente, la neuroimagen mostrará la presencia de un infarto territorial, usualmente con componente cortical, que en las secuencias RMDW (resonancia de difusión) aparecerá a veces fragmentado (ver FIGURAS 1-7 jpg). Mediante duplex o doppler transcraneal, angio-TAC o angio-RM, o angiografía se comprobará la interrupción, generalmente abrupta, de la arteria embolizada (Ver FIGURAS 1 y 5 jpg). Es posible que ya se haya iniciado una recanalización espontánea y el patrón de estenosis simule entonces un problema arterial local. En raras ocasiones esto puede ocurrir en la propia carótida cervical (Ver FIGURA 7 jpg). El resto del árbol arterial puede estar sano. Sin embargo, el requisito imprescindible para diagnosticar un ictus como cardioembólico es el hallazgo de una fuente cardiaca de émbolos; algunas cardiopatías, como la fibrilación auricular (FA) o las valvulopatías reumáticas tienen un potencial embólico muy bien definido, mientras que en otras la relación causa-efecto está peor establecida. La Tabla III (Ver tabla III jpg) recoge las distintas cardiopatías con capacidad embóligena, divididas como es habitual según el riesgo de embolismo. La mayoría de estas cardiopatías se diagnostican mediante la clínica y la ecocardiografía; a veces es preciso el estudio por vía transesofágica para alcanzar de forma adecuada el cayado aórtico, aurícula izquierda y tabique interauricular; la ecocardiografía es más rentable cuanto más precozmente se lleve a cabo, ya que marcadores de actividad trombótica intracavitaria como el eco-contraste espontáneo, o las bandas de fibrina, tienden a desaparecer. La rentabilidad del Holter de 24 horas para el diagnostico de arritmias paroxísticas está siempre en discusión; en todo caso, ante un embolismo criptogénico debe buscarse con ahínco una FA paroxística.
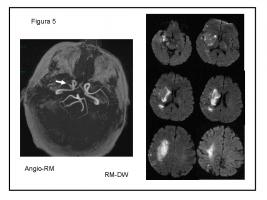
FIGURA 5.- Mujer, 62 años. Prótesis mecánica aórtica con anticoagulación insuficiente. Ictus en territorio de ACMD por oclusión proximal de M1 (flecha). Transformación hemorrágica en el territorio profundo.
ACMD: arteria cerebral media derecha.
FIGURA 6.- Mujer, 51 años. No factores de riesgo vascular. Ictus en territorio de ACMD. Membrana intra-auricular izda (flechas) compatible con cor triatriatum (Imágenes de ecocardiograma cortesía de de la Dra. Inés Uribe-Morales. Servicio de Cardiología, H. Virgen de las Nieves, Granada).
ACMD: arteria cerebral media derecha.
FIGURA 7.-
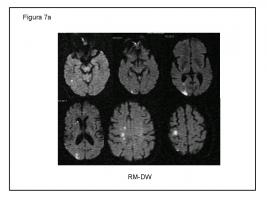
7 a.- Paciente de 59 años. HTA, Diabetes, Dislipemia, Tabaquismo. Arteriopatía en MM inferiores. Miocardiopatía isquémica severa (FE VI 25%) en FA. Déficit sensitivo motor y campimétrico en hemicuerpo izquierdo, instaurado en dos tiempos con 48 horas de intervalo. En la RM-DW múltiples lesiones puntiformes dispersas en territorio carotídeo derecho, algunas en territorios limítrofes, patrón sugerente de patología en carótida interna ipsilateral.
HTA: Hipertensión arterial. FE: fracción de eyección. RM DW: secuencias en resonancia de difusión. FA: fibrilación auricular.
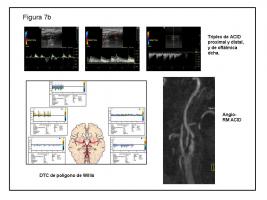
7 b.- Efectivamente, el estudio neurosonológico mostró signos indirectos de estenosis severa; un cono de sombra acústica impedía la valoración directa de la zona sospechosa, pero había un espectro pre-estenótico proximal, y baja velocidad y amortiguación del espectro distal, inversión de oftálmica, y ACMD con baja velocidad y curva amortiguada en el DTC. También la angio-RM mostraba una estenosis postbulbar severa y corta en ACID. Se mantuvo al paciente con el tratamiento que ya hacía por cardiología (anticoagulación oral, clopidogrel, estatinas, IECA, beta-bloqueante, diurético y antidiabéticos orales), y se propuso revascularización de ACID mediante angioplastia-“stenting”.
ACMD: arteria cerebral media derecha. DTC: Doppler transcraneal. ACID: Arteria carótida interna derecha. IECA: inhibidores de la enzima convertidora de angiotensina.
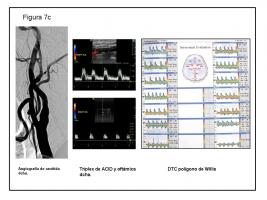
7 c.- El procedimiento hubo de demorarse 1 mes. Cuando se fue a llevar a cabo, la angiografía de ACID solo mostró irregularidades en el bulbo, pero sin estenosis significativas. En el estudio neurosonológico se comprobó la normalización de las alteraciones hemodinámicas previas. La explicación más verosímil es que la estenosis proximal de ACID estaba producida por un émbolo de origen cardiaco que eventualmente se disgregó.
ACID: Arteria carótida interna derecha.
TRATAMIENTO
El ictus cardioembólico debe ser tratado según los protocolos habituales de manejo del ictus isquémico agudo (Egido et al, 2006; Adams et al, 2007; ESO, 2008), preferentemente en una unidad de ictus; la monitorización que se lleva a cabo en estas facilita además el diagnóstico de arritmias ocultas. En cuanto al tratamiento específico, el ictus cardioembólico es buen candidato para los tratamientos repermeabilizadores, una vez que la neuroimagen descarte la presencia de sangrado; debe hacerse trombolisis por vía intravenosa cuando se cumplan los requisitos para ésta, bien sea de tiempo, o de existencia de amplia penumbra sobre la base de la neuroimagen avanzada (RM PW-DW o TAC multimodal), y posteriormente recurrir a tratamiento endovascular de rescate si no se consigue la repermeabilización. Un caso especial los constituye el ictus tras infarto de miocardio reciente, circunstancia en la que algunas guías contraindican la trombolisis intravenosa (Al-Khoury et al, 2004), probablemente con más fundamento especulativo que clínico (De Keyser et al, 2007). En la oclusión embólica de basilar o de arteria carótida interna intracraneal puede ser preferible recurrir directamente al tratamiento endovascular dada la baja tasa de recanalizaciones con tratamiento intravenoso; un capítulo especial lo constituyen los pacientes que estaban siendo anticoagulados; algunos protocolos como el del SITS-MOST (Wahlgren et al, 2007) excluían directamente a estos pacientes del tratamiento intravenoso, pero hoy se tiende a flexibilizar estos criterios y se admite el tratamiento cuando el INR es menor de 1’7 (Adams et al, 2007) o cuando la dosis de heparina de bajo peso molecular era “profiláctica”. En otro caso se puede recurrir al tratamiento local, siendo preferible el uso de medios mecánicos para extraer el trombo, para lo cual el número de dispositivos disponibles es creciente, pero también puede hacerse trombolisis farmacológica con uroquinasa o rTPA. Cuanto más precoz sea la reperfusión, mejor es el pronóstico funcional y más bajo el riesgo de hemorragia sintomática. Salvo para algunas situación apoyada por ensayos clínicos, como las oclusiones de ACM con una ventana de seis horas (Furlan et al, 1999), los tratamientos endovasculares del ictus agudo se encuentran bajo escrutinio.
Ante un ictus cardioembólico era común hasta recientemente instaurar anticoagulación con heparina no fraccionada por vía intravenosa para prevenir recurrencias precoces, pero se ha comprobado que las ventajas de esta estrategia quedan anuladas por las hemorragias cerebrales que induce la anticoagulación, ya que la tasa de recurrencias precoces es baja (Benavente et al, 2004). No se aconseja tampoco, en general, la “terapia puente” con heparina antes de establecer la anticoagulación oral para la prevención secundaria. (Hallevi et al, 2008).
Otro dilema clásico que se plantea con frecuencia, una de las situaciones llamadas “entre Escilla y Caribdis” (Hacke, 2000), es cuando se debe reanudar la anticoagulación en un paciente portador de una cardiopatía embolígena que ha sufrido una hemorragia cerebral mientras estaba anticoagulado (Wijdicks et al, 1998, Pahn et al, 2000; Benavente et al, 2004). Sobre la norma general de restablecer la anticoagulación lo antes posible, cada caso debe ser individualizado en función de sus propios riesgos.
El tratamiento de las peculiaridades de cada cardiopatía embolígena supera los objetivos de esta revisión.
PREVENCIÓN SECUNDARIA
En general, en las cardiopatías de alto poder embolígeno (FA en mayores de 65 años, o en menores de esa edad con otros factores de riesgo vascular asociados, valvulopatías reumáticas, prótesis valvulares mecánicas, miocardiopatía grave, infarto de miocardio reciente…) está justificado el uso de anticoagulación oral con antivitaminas-K (warfarina o acenocumarol), a veces como profilaxis primaria de embolismos, y por supuesto como profilaxis en prevención secundaria, con un INR diana de 2-3 en general; en los portadores de prótesis mecánicas se debe buscar el límite alto de ese rango. Las cardiopatías de bajo poder embolígeno constituyen un dilema a la hora de establecer el tratamiento profiláctico, y en general se prefiere la antiagregación plaquetaria salvo recurrencias, pero debe individualizarse cada caso. (Sacco et al, 2006; ESO, 2008). Otro tanto ocurre con la cirugía o el intervencionismo en el FOP (foramen oval permeable), que se trata en capítulo aparte, o en anomalías raras, como el cor triatriatum (Park et al, 2009)
El advenimiento de los inhibidores directos de la trombina va a modificar posiblemente el manejo de pacientes con cardiopatías embolígenas, comenzando por el de los pacientes con FA (Connolly et al, 2009). La asociación de ácido acetil-salicílico y clopidogrel puede ser una alternativa a la anticoagulación cuando ésta esté contraindicada (Connolly, 2009a); la relación coste-beneficio de estas estrategias está por determinar (Hankey, 2010). También se han estudiado como alternativa a la anticoagulación oral determinados dispositivos (PLAATO, WATCHMAN), que aíslan la orejuela de la aurícula izquierda con resultados alentadores (Möbius-Winkler, 2008).
BIBLIOGRAFÍA
Adams HP, del Zoppo G, Alberts MJ, Bhatt DL, Brass L, Furlan A et al. Guidelines for the Early Management of Adults With Ischemic Stroke. Stroke. 2007;38:1655-1711
Al-Khoury L, Lyden PD. (2004) Intravenous Thrombolysis. En: Mohr JP, Dennis DW, Grotta C, Weir B, Wolf PA (Eds). Stroke. Pathophisiology, Diagnosis, and Management. 4th Edition. (pp: 919-41). Philadelphia, USA, Churchill Livingstone;
Ay H, Furie KL, Singhal A, Smith WS, Sorensen AG, Koroshetz. An Evidence-Based Causative Classification System for Acute Ischemic Stroke. Ann Neurol 2005;58:688–97
Arboix A, Díaz J, Pérez- Sempere A y Álvarez-Sabín J (2006). Ictus: tipos etiológicos y criterios diagnóstico. En: Díaz-Tejedor E (Ed): Guía para el disgnóstico y tratamiento del ictus (pp: 1-23). Barcelona. Prous Science.
Benavente O, Sherman D. (2004). Secondary prevention of cardioembolic stroke. En: Mohr JP, Dennis DW, Grotta C, Weir B, Wolf PA (Eds). Stroke. Pathophisiology, Diagnosis, and Management. 4th Edition. (pp: 1171-86). Philadelphia, USA, Churchill Livingstone;
Caplan LR, Hier DB, D'Cruz I. Cerebral Embolism in the Michael Reese Stroke Registry. Stroke, 1983; 14: 530-36
Caplan LR. Of birds and nests and brain emboli. Rev Neurol (Paris). 1991;147: 265-73.
Castillo V, Bogousslavsky J. (1997) Brain embolism. En: Welch K.M.A, Caplan LR, Reis DJ, Siesjö Bk, Weir B (Eds). Primer on Cerebrovascular Diseases. (pp: 286-89). San Diego, California, EE UU. Academic Press.
Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Odgrem J, Parekh A et al., and the RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361:1139–51
Connolly SJ, Pogue J, Hart RG, Hohnloser SH, Pfeffer M, Chrolavicius S et al. Effect of Clopidogrel Added to Aspirin in Patients with Atrial Fibrillation. N Engl J Med 2009;360:2066-78
De Keyser J, Gdovinová Z, Uyttenboogaart M, Vroomen PC, Luijckx GJ. Intravenous alteplase for stroke: beyond the guidelines and in particular clinical situations. Stroke. 2007 Sep;38: 2612-8
Egido JA, Alonso de Leciñana M, Martínez Vila E, Díez Tejedor E (2006). Guía para el tratamiento del infarto cerebral agudo. En: Díaz-Tejedor E (Ed): Guía para el diagnóstico y tratamiento del ictus. pp: 97-132., Barcelona. Prous Science.
ESO (The European Stroke Organisation). Executive Committee and theESO Writing Committee. Guidelines for Management of Ischaemic Stroke and Transient Ischaemic Attack 2008. Cerebrovasc Dis 2008; 25: 457–507
Furie KL, Homma S, Kistler JP (2004). Cardiac diseases. En: Mohr JP, Dennis DW, Grotta C, Weir B, Wolf PA (Eds). Stroke. Pathophisiology, Diagnosis, and Management. 4th Edition. (pp: 747-59). Philadelphia, USA, Churchill Livingstone.
Furlan A, Higashida R, Wechsler L, Gent M, Rowley H, Kase C. Intra-arterial Prourokinase for Acute Ischemic Stroke. The PROACT II Study: A Randomized Controlled Trial. JAMA. 1999; 282: 2003-11
Hacke W. The Dilemma of Reinstituting Anticoagulation for Patients With Cardioembolic Sources and Intracranial Hemorrhage. How Wide Is the Strait Between Skylla and Karybdis? Arch Neurol. 2000;57: 1682-84.
Hallevi H, Albright KC, Martin-Schild S, Barreto AD, Savitz SI, Escobar MA et al.. Anticoagulation After Cardioembolic Stroke. To Bridge or Not to Bridge? Arch Neurol. 2008;65:1169-73
Hankey GJ. Replacing aspirin and warfarin for secondary stroke prevention: is it worth the costs? Curr Opin Neurol 2010; 23:65–72
Möbius-Winkler S, Schuler GC, Sick PB Interventional treatments for stroke prevention in atrial fibrillation with emphasis upon the WATCHMAN device. Curr Opin Neurol 2010; 21: 64–69
Park KJ, Park IK, Sir JJ, Kim HT, Park YI, Tsung PCh et al. Adult Cor Triatriatum Presenting as Cardioembolic Stroke. Inter Med, 2009; 48: 1149-52
Phan TG, Koh M, Wijdicks EFM. Safety of Discontinuation of Anticoagulation in Patients With Intracranial Hemorrhage at High Thromboembolic Risk Arch Neurol. 2000;57:1710-13.
Ribó M. (2008). Historia natural y prevención en el ictus cardioembólico. En Montaner J (Ed). Prevención del ictus isquémico. (pp: 156-72), Barcelona, ICG Marge SL.
Sacco RL, Adams R, Albers G, Alberts MJ, Benavente O, Furie K. Guidelines for Prevention of Stroke in Patients With Ischemic Stroke or Transient Ischemic Attack. Stroke. 2006; 37: 577-617.
Wahlgren N, Ahmed N, Dávalos A, Ford GA, Grond M, Hacke W et al. SITS-MOST investigators. Thrombolysis with alteplase for acute ischaemic stroke in the Safe Implementation of Thrombolysis in Stroke-Monitoring Study (SITS- MOST): an observational study. Lancet. 2007 ;369(9558): 275-82
Wijdicks EF, Schievink WI, Brown RD, Mullany CJ. The dilemma of discontinuation of anticoagulation therapy for patients with intracranial hemorrhage and mechanical heart valves. Neurosurgery. 1998; 42: 769-73.
- 78008 lecturas