Vasoespasmo e isquemia cerebral diferida en la hemorragia subaracnoidea espontanea
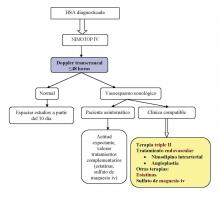
DIAGNÓSTICO DEL VASOESPASMO:
Esta complicación aparece por lo general entre el 4º y el 12º día, habiéndose dado casos de vasoespasmo hasta varias semanas después del sangrado inicial. La presencia de vasoespasmo angiográfico se da hasta en el 66% de los pacientes, pero el vasoespasmo sintomático ronda tan solo el 30%. Se considera a esta complicación como la responsable del 20% de la morbimortalidad en las HSA, siendo la principal causa de morbimortalidad retardada, y de carácter más intenso según la cantidad de sangre inicial. La presentación típica es la aparición de un deterioro neurológico en un paciente sin hidrocefalia ni resangrado que los justifique, con un TC craneal basal sin alteraciones relevantes en sus fases precoces. Puede asociar fiebre y confusión. El concepto del vasoespasmo está cambiando sustancialmente en los últimos años, y son muchas las moléculas que se están investigando para optimizar la prevención y el tratamiento de esta complicación. Su nomenclatura tiende a ser confusa, pues a veces el término se intercambia indistintamente con el de isquemia cerebral diferida, pero ni todos los pacientes que presentan vasoespasmo tienen isquemia cerebral diferida, ni esta aparece solo cuando hay vasoespasmo. En no pocas ocasiones la circulación proximal es de características normales, y sin embargo se producen cambios en la microcirculación distal, que conducen finalmente a la isquemia (Laskowitz, 2010). Es la salida de sangre al espacio subaracnoideo y la hemólisis secundaria de los hematíes, lo que promueve el desarrollo de la isquemia cerebral diferida por afectación de la unidad neurovascular. La liberación de los productos de los hematíes lisados origina una descompensación entre sustancias vasodilatadoras (óxido nítrico, prostaciclina) y vasoconstrictoras (tromboxano A2, endotelina), con mayor actividad de estas últimas, desencadenando una cascada inflamatoria y tromboembólica. Existen probablemente polimorfismos genéticos, que hacen a los individuos portadores más susceptibles de padecer esta complicación, como puede ser el caso de las variaciones individuales en la sintasa endotelial del óxido nítrico (eNOS). A nivel de la circulación proximal, en la región de las cisternas, en la que se sitúan las grandes arterias del polígono de Willis, el vasoespasmo es detectable por pruebas angiográficas y sonológicas, sin embargo esta complicación puede ser silente con este tipo de pruebas si afecta de forma exclusiva a la vasculatura distal, a nivel de la microcirculación, detectable en este caso por pruebas funcionales como el TC de perfusión o la RM de difusión/perfusión (Rabinstein, 2010).
Para su detección y monitorización se pueden emplear diversas técnicas:
Doppler transcraneal: Está técnica no cruenta es una herramienta diagnóstica muy útil por su gran accesibilidad, teniendo en cuenta que ofrece una sensibilidad cercana a la angiografía para la detección del vasoespasmo en las grandes arterias del polígono de Willis, sobre todo para la arteria cerebral media. Se puede realizar por ejemplo cada 2 días como medida de monitorización, o cuando se produzcan cambios en el estado clínico sugestivos de vasoespasmo, siendo aconsejable tener un registro basal de los primeros días. El problema de esta técnica es la mala ventana ecográfica que tienen hasta el10% de los pacientes, y que es explorador dependiente.
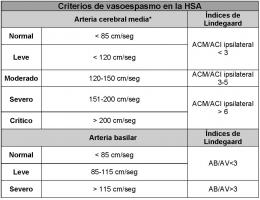
La sensibilidad del doppler trasncraneal para el diagnóstico de arterias de gran calibre (vasos proximales del polígono de Willis) es elevada (en torno al 80%), el aumento de las velocidades medias permite clasificar el vasoespasmo en diferentes grados (Ver Tabla Criterios de vasoespasmo HSA jpg). Para mayor fiabilidad se emplean los índices de Lindegaard, que comparan la velocidad de la arteria intracraneal con la de la arteria cervical, evitando diagnosticar de vasoespasmo elevaciones de la velocidad secundarias a hiperaflujo o hiperemia. Es la elevación relativa de las velocidades de las arterias intracraneales con respecto a las cervicales, la que ofrece datos de vasoespasmo franco. Un índice > 3 se corresponde con la presencia de vasoespasmo angiográfico, que si asciende a 5-6, será de carácter severo.
Tabla Criterios de vasoespasmo en la HSA. HSA: Hemorragia subaracnoidea. ACM Arteria cerebral media. ACI: Arteria carótida interna. AB: Arteria basilar. AV: Arteria vertebral; cm/seg: centímetros por segundo.
*Cifras similares pueden estimar la presencia de vasoespasmo en la arteria cerebral anterior y carótida interna distal.
Las cifras de velocidades de la tabla hacen referencia a la Velocidad media: (Vm) = [Velocidad sistólica (Vs) –Velocidad diastólica (Vd)]/ 3 + Vd.
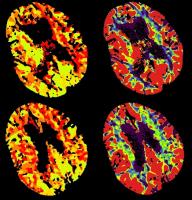
TC de perfusión: Su uso se está extendiendo de forma creciente, ya que da un diagnóstico funcional del estado circulatorio global, estimando tanto la isquemia cerebral dependiente de los grandes vasos, como la de la microcirculación. El vasoespasmo severo en esta técnica se asocia a flujos cerebrales absolutos < 25 ml/100g/min, tiempos de tránsito medio > 6,5 seg, teniendo este último punto de corte un valor predictivo negativo del 98,7% en relación con la angiografía (Rabinstein, 2010). Otros autores confieren al retraso en el tiempo al pico el parámetro más objetivo para determinar la presencia de vasoespasmo.
Figura vasoespasmo TC de perfusión: Marcado vasoespasmo en arterias cerebrales anteriores, arterias cerebrales medias, arterias comunicantes anteriores y arterias carótidas internas supraclinoideas con aumento secundario del tiempo al pico en sus territorios de vascularización.
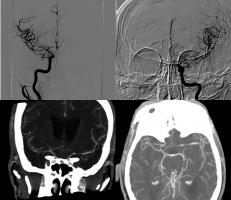
Figura Angio vasoespasmo: En el estudio de angio TC y arteriografía de la misma paciente se observa marcada disminución del calibre de ambas arterias carótidas internas supraclinoideas, ambas arterias cerebrales medias (M1 y M2 bilateral), arterias comunicantes anteriores y arterias cerebrales anteriores en relación con intenso vasospasmo.
Otras técnicas diagnósticas que se emplean en este cometido, complementariamente a la arteriografía, que es el gold estandar, son la resonancia magnética con secuencias de angio RM y de perfusión/difusión que permitan valorar la presencia mismatch (penumbra isquémica que traduce riesgo de isquemia cerebral diferida), la saturación yugular de oxígeno, y la presión tisular de oxígeno.
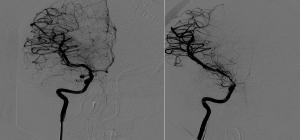
Figura: Arteriografías de carótida interna derecha en proyección AP de la misma paciente en el día 0 de una hemorragia subaracnoidea (imagen izquierda) en la que se observa el aneurisma de arteria comunicante posterior responsable del sangrado. La imagen de la derecha muestra la misma arteria 7 días después. Se observa marcado vasoespasmo de la división carotídea y de los segmentos A1 y M1 derechos.
TRATAMIENTO:
Prevención del vasoespasmo:
Nimodipino: La prevención del vasoespasmo se debe iniciar desde el momento del diagnóstico de la HSA con nimodipino, bien en forma oral o intravenosa, no habiendo demostrado un beneficio mayor la forma parenteral, pero permitiendo es este caso una administración más uniforme del fármaco. Es preferible el empleo de una vía central o un drum. La perfusión intravenosa se realiza aumentando las dosis de forma progresiva y con un control estricto de la presión arterial (PA). Se inicia a un ritmo de 3 μg/kg de peso/h. Según la PA se va incrementando a un ritmo de 0,2 mg = 1 ml/h hasta llegar a la dosis de mantenimiento de 30 μg/kg de peso/h. El nimodipino por vía intravenosa se mantiene 14 días, pasando entonces a la administración oral de 360 mg/día hasta el día 21 de evolución.
Estatinas: Se ha señalado que la instauración de tratamiento con estatinas después de una HSA aneurismática reduce la incidencia de vasospasmo, déficit isquémicos tardíos y mortalidad. El beneficio se ha relacionado con las propiedades antiinflamatorias y vasodilatadoras, estas últimas en base a la regulación positiva que realizan sobre la óxido nítrico sintasa endotelial. Entre las diversas estatinas se han empleado 40 mg de pravastatina y 80 mg de simvastatina (Sillberg, 2008). En estudios posteriores se ha buscado refrendar el beneficio de los trabajos preliminares, sin que los resultados hallados se hayan conseguido corroborar para extender su indicación (Vergouwen 2009).
Sulfato de magnesio: El sulfato de magnesio tiene propiedades vasodilatadores por su efecto calcio-antagonista, y puede actuar en este sentido de forma sinérgica con el nimodipino. Se le confieren a su vez propiedades neuroprotectoras al inhibir la liberación del glutamato, y también efectos antiagregantes, sin que se asocie este hecho al aumento de complicaciones hemorrágicas (Stippler, 2006a). Se considera que existe hipomagnesemia cuando las cifras de magnesio son < 0,7 mmol/litro. En varios ensayos pilotos randomizados se han señalado sus beneficios para la prevención del vasoespasmo o isquemia cerebral diferida. Los pacientes que recibían este fármaco presentaban mejor evolución que los controles. Su uso se considera en general seguro, pero pueden aparecer efectos secundarios que deben ser vigilados en forma de hipotensión, hipocalcemia o bradicardia. Recientemente ha sido publicado el estudio fase III multicéntrico IMASH (Wong 2010), registrado en www.strokecenter.org/trials, que reclutó a 327 pacientes, con el objeto de confirmar los resultados preliminares. En este estudio randomizado no se observaron diferencias significativas en ninguno de los parámetros estudiados, que incluyeron el pronóstico funcional y la aparición de vasoespasmo clínico. Estos resultados cuestionan actualmente la eficacia del magnesio en el manejo de la HSA aneurismática. Se encuentra en marcha el estudio MASH-II, cuyo objetivo es reevaluar si hay diferencias con la administración de magnesio intravenoso, en cuanto a la discapacidad empleando la escala de Rankin modificada (eRm). La dosis empleada es de 30 mg/kg día, tras carga de 10 mg/kg intravenosos, con el objetivo de conseguir unas concentraciones plasmáticas entre 1,28-1,62 mmol/litro, en combinación con la administración de nimodipino (Dorhout Mees SM, 2007). La medicación se puede administrar desde las 48 horas tras la HSA, mezclando 12 gr de sulfato de magnesio en 500 ml de suero salino al 0,9% en 24 horas a pasar a 21 ml/hora (Stippler, 2006b). Otros autores dan un margen terapéutico algo más amplio: 1-2 mmol/litro, empleando 64 mmol/día entre los días 4º y 14 º tras el sangrado inicial (Walter M, 2005). Se puede pautar a pesar de que el paciente presente cifras basales de magnesio normales.
Otras terapias: Se han señalado otro tipo de alternativas terapéuticas para la prevención del desarrollo de vasoespasmo, siendo considerado a día de hoy su beneficio no demostrado, es el caso de los antagonistas de la endotelina, el lavado cisternal con o sin fibrinolíticos, la anticoagulación con heparinas, los scavengers de radicales libres (Tirilazad), e incluso la agitación de la cabeza.
Tratamiento del vasoespasmo:
A pesar de que tradicionalmente se ha recurrido a la terapia triple H (hipervolemia, hipertensión y hemodilución) como primera línea de terapia cuando el vasoespasmo está ya instaurado y es sintomático, actualmente tan solo se recomienda evitar una situación de hipovolemia, debido a que el forzar la hipervolemia se asocia a efectos indeseables en forma de sobrecarga cardiaca, o edema pulmonar entre otros. Además esta terapia tiene el riesgo de provocar el resangrado del aneurisma de no estar este cerrado. Para producir hipervolemia o euvolemia, se pueden emplear bolos de salino a dosis de 15 ml/kg en 1 hora. Para inducir hipertensión se pueden emplear vasopresores como la dopamina y la dobutamina, la vasopresina no es recomendable, por el riesgo de desencadenar hiponatremia. Si el paciente es refractario a estas medidas, o muestra signos de sobrecarga hídrica que contraindiquen su empleo, se puede recurrir al intervencionismo neurovascular, mediante la infusión de sustancias vasodilatadores locales como el nimodipino intrarterial o el verapamilo, o directamente con angioplastia (más efectiva y duradera, pero que conlleva un 5% de riesgo de rotura de la arteria). La papaverina, otro vasodilatador local que se aplicaba antiguamente, ha caído en desuso por los efectos secundarios que produce en forma de hipertensiójn intracraneal (Rabinstein, 2010).
BIBLIOGRAFÍA
• Bederson JB, Connolly ES Jr, Batjer HH, Dacey RG, Dion JE, Diringer MN et al.(2009). Guidelines for the management of aneurysmal subarachnoid hemorrhage: a statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 40:994-1025.
• Dorhout Mees SM, van den Bergh WM, Algra A, Rinkel GJ. Achieved serum magnesium concentrations and occurrence of delayed cerebral ischaemia and poor outcome in aneurysmal subarachnoid haemorrhage. J Neurol Neurosurg Psychiatry. 2007 Jul;78(7):729-31.
• Hemorragia subaracnoidea. Wikipedia la enciclopedia libre. Acceso el 15-5-2010: http://es.wikipedia.org/wiki/Hemorragia_subaracnoidea
• Jose I. Suarez, M.D., Robert W. Tarr, M.D.,and Warren R. Selman, M.D. Aneurysmal Subarachnoid Hemorrhage. N Engl J Med 2006;354:387-96.
• Laskowitz DT, Kolls BJ. Neuroprotection in subarachnoid hemorrhage. Stroke. 2010 Oct;41(10 Suppl):S79-84. Review.
• Rabinstein Alejandro A, Giuseppe Lanzino, Eelco F M Wijdicks. Multidisciplinary management and emerging therapeutic strategies in aneurysmal subarachnoid haemorrhage. Lancet Neurol 2010; 9: 504–19.
• Sillberg, BSc Victoria A.H.; George A. Wells, MSc, PhD; Jeffrey J. Perry. ¿Mejoran las estatinas los resultados y reducen la incidencia de vasospasmo tras una hemorragia subaracnoidea aneurismática? Un metanálisis. Stroke. 2008;39:2622-2626.
• Stippler, Martina M.D., Elizabeth Crago, et al., MMagnesium infusion for vasospasm prophylaxis after subarachnoid hemorrhage. J. Neurosurg. / Volume 105 / November, 2006.
• Vergouwen MD, Meijers JC, Geskus RB, et al. Biologic eff ects of simvastatin in patients with aneurysmal subarachnoid hemorrhage: a double-blind, placebo-controlled randomized trial. J Cereb Blood Flow Metab 2009; 29: 1444–53.
• Walter M. van den Bergh; on behalf of the MASH Study Group Magnesium Sulfate in Aneurysmal Subarachnoid Hemorrhage A Randomized Controlled Trial. Stroke. 2005;36:1011-1015.
• Vivancos, J, F. Rubio, L. Soler y N. Vila; por el comité ad hoc del Grupo de Estudios de Enfermedades Cerebrovasculares de la SEN. Capítulo 7. Guía De Actuación Clínica En La Hemorragia Subaracnoidea 2004.
• Wong GK, Poon WS, Chan MT, Boet R, Gin T, Ng SC, Zee BC; IMASH Investigators. Intravenous magnesium sulphate for aneurysmal subarachnoid hemorrhage (IMASH): a randomized, double-blinded, placebo-controlled, multicenter phase III trial. Stroke. 2010 May;41(5):921-6. Epub 2010 Apr 8.
- 91978 lecturas