RM Craneal en patología vascular cerebral
INTRODUCCIÓN
La Resonancia Magnética (RM) craneal obtiene una mayor resolución de imagen de tejidos blandos que otras técnicas de imagen, lo cual es muy beneficioso en la evaluación del parénquima encefálico y de la fosa posterior. Asimismo, ofrece ventajas frente al TC para evaluar los vasos arteriales y venosos intracraneales y del cuello, permitiendo la separación de la circulación arterial y venosa (dependiente de las diferencias de velocidad y dirección del flujo) algunas veces sin necesidad de inyección de medio de contraste intravenoso (IV).
INCONVENIENTES
Es una técnica cara y menos accesible y disponible que la TC.
Por el uso de un campo magnético está contraindicada para evaluar pacientes portadores de marcapasos o de neuro-estimuladores y en algunas válvulas cardiacas o prótesis metálicas (Shellock 2007). En todo caso se puede consultar la compatibilidad magnética de los diferentes objetos y recordar que a veces, aunque sean compatibles no nos permiten obtener imagen de RM en su entorno por la distorsión ferromagnética local de la imagen.
Los pacientes deben colaborar inmóviles para obtener imágenes válidas.
Las exploraciones son largas (para evaluar sólo el parénquima pueden ser necesarios entre15 y 20 minutos pero los estudios angiográficos de alta calidad o secuencias especiales pueden alargar la exploración hasta los 40-50 minutos.
En pacientes claustrofóbicos, niños o pacientes no colaboradores puede ser necesario realizar la RM bajo anestesia con equipos de monitorización específicos compatibles con RM. En casos de urgencia médica y pacientes poco colaboradores se pueden obtener secuencias rápidas de peor calidad en pocos minutos, pero que para evaluar isquemia aguda pueden ser muy útiles para el manejo terapéutico.
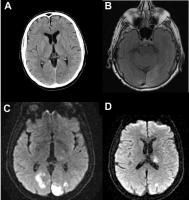
No todos los equipos de RM son iguales. Para la evaluación de patología vascular cerebral es deseable utilizar equipos de alto campo (igual o mayor de 1.5 Tesla). Pero hoy en día también hay equipos de campo medio (1 T) o bajo campo (0.2- 0.5 T) con software avanzado que permiten realizar secuencias vasculares aceptables. Los equipos de mayor potencia 3 Tesla no están tan accesibles, aunque ofrecen indudables ventajas en calidad de imagen y rapidez. En todo caso, hoy en día no se debería realizar exploraciones de RM en pacientes cerebro-vasculares en equipos que no dispongan de capacidad de realizar secuencias de Difusión. La Difusión debe realizarse en todos los estudios cerebrales ya que permite detectar isquemia aguda no sospechada y caracteriza otras lesiones como los epidermoides y abscesos cerebrales. La Difusión es una secuencia muy corta que solo requiere 20-30 segundos (Schaefer 2000). (Ver Fig1 jpg)
Figura 1 A. CT de paciente con hemianopsia izquierda de 2 horas de evolución. Discerta hipodensidad y borramiento de la diferenciación sustancia blanca-sustancia gris occipital medial izquierda. RM a las 24 horas FLAIR (B) y Difusión (C,D), lesiones múltiples en territorio vertebro-basilar, occipitales bilaterales y tálamo derecho, compatible con émbolos en paciente con fibrilación auricular paroxística.
La utilización de contraste paramagnético (Gadolinio IV dosis 0.2mmol/kg) mejora la evaluación de vasos pequeños, permite estudios dinámicos y perfusión, pero debemos recordar que no puede realizarse en pacientes con insuficiencia renal (creatinina >1.5) por el riesgo de nefroesclerosis (Kuuo 2007, Thomsen 2009, www alerta nefrosclerosis)
REALIZACIÓN
La exploración se dirige por la sospecha clínica, y se puede ampliar según los hallazgos añadiendo técnicas y secuencias especiales.
El estudio básico de RM cerebral de un paciente con factores de riesgo vascular requiere de al menos 4 secuencias en 3 planos: T1, FLAIR, T2 y DIFUSIÓN que requiere en total entre 15 y 20 minutos.
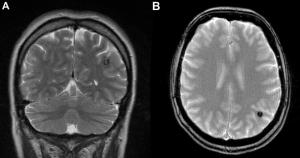
Si se sospecha una lesión hemorrágica, cavernoma o en pacientes mayores de 60 años debemos añadir una secuencia de gradiente (T2*) o de Susceptibilidad para detectar mejor depósitos de hemosiderina (angiopatía hipertensiva y angiopatía amiloidea). (Ver Figuras 2 y 3 jpg).
Figura 2. Cavernoma subcortical parietal izquierdo: A) T2 coronal y B) T2* gradiente axial, donde la hemosiderina aumenta la hiposeñal.
Figura 3. Amiloide cerebral. A) AxT2* micro depositos de hemosiderina subcorticales parietales. B) Hematoma subcortical coronal T2 y C) coronal T1.
El uso de contraste intravenoso puede realizarse para evaluar mejor los vasos, para detectar rotura de la barrera hemato-encefálica, o para diferenciar de otras patologías…
Pueden usarse técnicas de Perfusión con contraste IV (o si se dispone de ASL sin contraste IV) para medir tiempo de tránsito medio (TTM), flujo sanguíneo cerebral (FSC) y volumen sanguíneo cerebral (VSC) en la evaluación del ictus agudo y su posible tratamiento (Srinivasan 2006).
ANGIO-RESONANCIA (ARM)
Las técnicas TOF (Time of Flight) y PC (Phase Contrast) permiten obtener mayor señal de flujo en el interior de los vasos, para ello hay que optimizar los parámetros de la secuencia: ángulo del vector de magnetización, TE, TR y grosor de corte, así como la dirección y velocidad de flujo del vaso que queremos estudiar. La calidad de las antenas de superficie disponibles (bobinas multicanal) y potencia de los gradientes magnéticos del equipo también mejoran la calidad de las imágenes. Las técnicas de ARM utilizan pulsos de excitación que anulan la señal del tejido estacionario y aumentan la señal de los espines móviles, y si además se administra gadolinio intravenoso con bomba de infusión (generalmente en doble dosis) y se adquieren las imágenes en la fase arterial o venosa deseada, se obtiene mayor señal intravascular (sobre todo en vasos pequeños, estenosis o regiones de vasos tortuosos o que caen en el plano del estudio). Siempre se debe optimizar la sincronización de la llegada del bolo de contraste a la región a explorar con la adquisición de las imágenes, con las técnicas disponibles en cada equipo de RM (bolus racking). El gadolinio tiene un efecto paramagnético de acortar el tiempo de relajación (TR), obteniendo mayor hiperseñal en T1. La adquisición debe ser perpendicular al vaso y en contra de la dirección del flujo, y además se pueden aplicar bandas de saturación que eliminen la señal del flujo en otras direcciones. Hay que recordar que en las secuencias TOF todas las anomalías hiperintensas en T1 dan señal hiperintensa (grasa, proteínas y metahemoglobina). Así los trombos subagudos intravasculares, o en aneurismas parcialmente trombosados, o en disecciones, darán señal hiperintensa en T1 que puede ser difícil de separar de la señal del flujo intravascular (Oleaga 2009).
En todos los casos las imágenes de ARM o ACT requieren un postproceso y reconstrucción por personal cualificado que conozca estos problemas técnicos y la anatomía vascular para obtener imágenes 3D adecuadas, sin sobreestimación de estenosis, sin artefactos, ni pérdida de vasos o información, para su posterior interpretación por el especialista de imagen vascular. Se pueden post procesar con MPR (Reconstrucción Multiplanar), MIP(reconstrucción en Proyección de Máxima Intensidad), reconstrucción curvilínea del vaso, VR (Volume Rendering), SSD (Shaded Surface Display) o endoscopia virtual. Cada una de estas técnicas posee ventajas e inconvenientes inherente diferentes, por lo que se suelen combinar varias de ellas y ninguna es completa por sí sola (Leach 2006, Glockner 2005).
Si se sospechan aneurismas cerebrales en pacientes de riesgo (antecedentes familiares o enfermedades predisponentes) se puede realizar angioresonancia (ARM) sin contraste, ya que la evaluación intracraneal de fosa posterior y polígono de Willis es relativamente pequeña y se puede hacer con corte fino sin contraste en toda su extensión. Debemos sin embargo tener en cuenta que la resolución hoy en día con 1.5T o campo mayor permite detectar aneurismas de hasta 2mm de diámetro (pero con limitaciones según su localización).
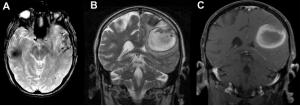
Para el seguimiento de aneurismas embolizados es imprescindible aportar información sobre el material de embolización (coils o stents ) y su localización, ya que estos materiales metálicos pueden no permitir evaluar los vasos adyacentes de forma adecuada, ni siquiera con administración de contraste IV (Ver Fig. 4 jpg). Además se deben realizar estudios completos de imagen incluyendo el parénquima cerebral, la pared y el posible trombo periférico del aneurisma además del flujo intra-arterial. En la evaluación del cuello aneurismático residual tras embolización es preferible administrar contraste IV (Wallace 2007).
Figura 4 A)Reconstrucción Volume Rendering (VR) de angio RM (sin contraste) de un aneurisma gigante supraclinoideo embolizado con stents, se pierde la señal en la carotida cavernosa y supraclinoidea izquierda por los stents. B) Coronal T2 del aneurisma gigante supraclinoideo del mismo paciente.
En la sospecha de trombosis de senos venosos se pueden realizar secuencias de flujo 2D y 3D TOF o PC sin y con contraste. Para evaluar las venas corticales o senos pequeños es siempre recomendable realizar estudios 3D con contraste. En los casos de trombos corticales es preferible realizar ambos estudios sin y con contraste. Los senos venosos profundos y los senos cavernosos son más complejos de evaluar, siendo más difícil detectar trombos en su interior, pero se pueden detectar patrones de desvío/recirculación del flujo venoso. (Leach 2006) (Liang 2001).
Evaluación de Troncos Supra aorticos (TSA):
Para realizar una exploración completa desde cayado aórtico a vasos silvianos intracraneales en el estudio de la estenosis carotídea arteriosclerótica es preferible usar técnicas 3D TOF con contraste IV. Las técnicas 3D PC y 2D TOF sin contraste presentan mayor pérdida de señal en regiones de flujo turbulento (bulbo carotídeo) o tramos horizontales al plano de estudio (bucles, trayectos petrosos y cavernosos). En general las imágenes son de mejor calidad si se obtienen dos adquisiciones una basal o “máscara” sin contraste y otra en la fase arterial con el bolo de contraste, realizando posteriormente una substracción para obtener mayor señal y eliminación de la señal del tejido estacionario.
Con 3D TOF con Gd IV se evalúa bien el flujo intravascular, los orígenes de los vasos y las estenosis, pero no la pared vascular. El método de análisis de estenosis por tanto debe ser en NASCET que compara la luz mínima en el punto de máxima estenosis con el vaso distal de calibre normal. Hay que centrar adecuadamente el volumen del estudio con la anatomía del paciente, evitando que queden fuera del volumen de adquisición el sistema vertebro-basilar o bucles vasculares. En algunos casos de cifosis extrema hay pacientes que no pueden estudiarse por la falta de adaptación de las antenas que cubren el cuello del paciente.
Los inconvenientes principales de la ARM son los artefactos de movimiento respiratorio o de deglución que pueden degradar las imágenes, y los artefactos asociados a metal de cirugías cercanas o stents que anulan la señal de flujo.
Existen técnicas de flujo con sangre negra que permiten evaluar mejor la pared y composición de la placa de ateroma. Son secuencias SE o FSE o de doble inversión.
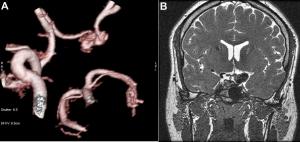
Las malformaciones arteriovenosas cerebrales (MAV) se pueden estudiar y seguir con angio RM, con la ventaja de no usar radiación ionizante y sin necesidad de contraste intravenoso.
Figura 5. Malformación arteriovenosa parcialmente embolicada. Angio RM 3D VR.
BIBLIOGRAFIA
Glockner JF.(2005) MR Radiology Interpretation: Techniques and pitfalls. Magnetic Resonance Imaging Clinics N Am.13:23-40.
Hadizadeh DR et al (2007) Cerebral Arteriovenous Malformation Spetzler-Martin Classification at subsecond-temporal-resolution four-dimensional MR angiography compared with that at DSA. Radiology 19:
Kuuo PH, Kanal E, Abu-AlfaAK, Cowper SE, 2007. Gadolinium based MR contrast agents and Nephrogenic Systemic Fibrosis: Risk factors and incidence estimation. Radiology.
Lell MM et al. Clinical Aplications of vascular Imaging. New Techniques in CT Angiography. Radiographics 2006;26:S45-S62.
Leach JM, Fortuna RB, Jones BV, Gaskill-Shipley MF (2006) Imaging of Cerebral Venous Thrombosis: Current Techniques, Spectrum of Findings, and Diagnostic Pitfalls. Radiographics; 26:S19-S43.
Liang L et al. Evaluation of the intracraneal dural sinuses with a 3D contrast-enhanced MP-RAGE sequence. AJNR 22:481-92.
Oleaga Zufira L (2009). Diagnóstico no invasivo de la patología de los troncos supraaorticos, Radiología Esencial (pp1128-1137). Ed Panamericana.
Schaecer PW, Grant PE, Gonzalez RG. Diffusion-weighted MR Imaging of the brain. Radiology 2002;217:331-345.
Shellock FG (2007) Reference Manual for Magnetic Resonance Safety, Implants, and devices. Ed: Biomedical Research Publishing Group.
Srinivasan A, Goyal M, Al Azri F, Lum C (2006) State of the Art Imaging of Acute Stroke. Radiographics;26:S75-S95.
Thomsen HS. 2009. How to avoid nephrogenic systemic fibrosis: current guidelines in Europe and the United States. Radiol Clin North Am. 2009 Sep;47(5):871-5, vii.
Wallace (2007) Non invasive Imaging of Treated Cerebral Aneurysms, part I: MRI of coiled aneurysms. AJNR 28(6):1002-1008.
Alerta Nefroesclerosis asociada al gadolinio:
http://www.aemps.es/actividad/alertas/usoHumano/seguridad/home.htm
- 101297 lecturas