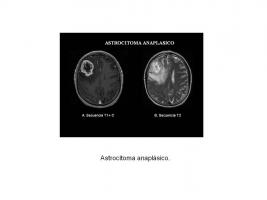
Astrocitoma anaplásico (grado III)
RESUMEN
El astrocitoma anaplásico (AA) es un glioma de grado III que constituye el 4% de todos los tumores primarios del SNC. La mayoría de los casos se presentan en la edad adulta (el 60% de los casos se diagnostican entre los 45 y los 69 años). La imagen en RM generalmente muestra una lesión solida expansiva con edema asociado que capta contraste de manera uniforme. El AA puede proceder de tumores de grado inferior en su vía de diferenciación a glioblastoma (GB) secundario y tiene una tendencia importante a evolucionar a GB con una mediana de tiempo de dos años. Se caracteriza histológicamente por atipia nuclear, aumento de la celularidad y una actividad proliferativa significativa. El tratamiento clásico del astrocitoma anaplásico comprende resección quirúrgica y radioterapia. Se desconoce en la actualidad si el AA puede beneficiarse del mismo enfoque terapéutico que el GB (quimio-radioterapia adyuvante post-quirúrgica o régimen de Stupp).
INTRODUCCIÓN
El AA, astrocitoma grado III según la clasificación de la OMS 2007, constituye el 4% de todos los tumores primarios del sistema nervioso central. En Europa, el 60% de los casos se diagnostican entre los 45 y los 69 años. En este grupo de edad la tasa de incidencia anual se encuentra entre 0.5 y 0.7 por 100,000 (Sant et al; 2009). Entre los datos obtenidos del análisis de los registros epidemiológicos de cáncer de 18 países europeos (EUROCARE) destaca una incidencia estable desde 1984 y un aumento progresivo de las tasas de supervivencia (aumento de un 26% a un 43% la supervivencia a un año entre 1983 y 1994). Aunque varios síndromes hereditarios se han relacionado con una predisposición a la aparición de AA (Neurofibromatosis tipo I y II, esclerosis tuberosa y Sd. de Li Fraumeni) y se han encontrado asociaciones epidemiológicas con la exposición prolongada a tóxicos ambientales (clorhidrato de metileno, derivados del petróleo (Heineman et al; 1994)) o estímulos electromagnéticos (pan-orto-tomografías, teléfonos móviles (Hardell et al; 2002)), la etiología de estas neoplasias aun se desconoce.
MANIFESTACIONES CLÍNICAS
La sintomatología de presentación varía en función de la localización tumoral, el tamaño y el edema asociado. Es frecuente la aparición de crisis epilépticas, alteraciones visuales, déficits focales o deterioro cognitivo progresivo.
NEUROIMAGEN
La valoración radiológica de la lesión tras su detección consiste en la determinación del número de lesiones, la caracterización de la imagen, la extensión de la afectación y la elocuencia del tejido cerebral subyacente. Todo ello es importante para decidir el tipo de tratamiento quirúrgico que puede realizarse. La imagen en RM generalmente muestra una lesión solida expansiva con edema asociado. Es diferente de la del GB, pues no muestra la imagen típica en anillo, sino que en general son lesiones que captan contraste de forma uniforme. La presencia de calcificaciones o necrosis es infrecuente, pero siempre será necesaria la confirmación histológica para un adecuado diagnóstico. Los gliomas suelen presentar zonas con distinta agresividad, y, aunque el realce post-contraste se considera un criterio de sospecha de agresividad, el 30% de los AA no se realza [Astrocitoma anaplásico.jpg].
Dado que son tumores que no metastatizan, no es necesario realizar estudio de extensión extracraneal. Ocasionalmente se ha observado diseminación intracraneal en largos supervivientes y la presencia de metástasis es excepcional y generalmente relacionada con contaminación durante la cirugía).
HISTOPATOLOGÍA
El AA puede proceder de tumores de grado inferior en su vía de diferenciación a glioblastoma (GB) secundario y tiene una tendencia importante a evolucionar a GB con una mediana de tiempo de dos años. Se caracteriza histológicamente por atipia nuclear, aumento de la celularidad y una actividad proliferativa significativa. En este contexto, la presencia de proliferación vascular sin necrosis asociada se considera en la actualidad criterio suficiente para el diagnóstico de GB. El AA se presenta en pacientes más jóvenes que el GB y tiene mejor pronóstico [Histopatología astrocitoma anaplásico.jpg].
BIOLOGÍA MOLECULAR
La anomalía genética más común en la evolución de los astrocitomas grado II es la alteración de TP53 (> 59%). En el AA secundario se han descrito mutaciones similares, pero aparecen nuevas alteraciones, como la mutación o supresión de p16INK4A o pRB1 (locus de susceptibilidad del retinoblastoma 1) o amplificación o sobreexpresión de ciclina dependiente de quinasa (CDK4) y ‘Human double minute 2’ (HDM2).
PRONÓSTICO
Para el GB y el AA existe una clasificación pronóstica, basada en recursive partitioning análisis (RPA), descrita en 1993 y validada en 1998 (Scott et al; 1998), que permite identificar aquellos pacientes que pueden beneficiarse del tratamiento oncológico y también la comparación de resultados entre diferentes estudios. Sin embargo, a diferencia de otras enfermedades oncológicas, no permite la selección de tratamiento específico, es decir, no funciona como una estadificación clínica. Entre los factores de buen pronóstico se incluyen el grado histológico III, la edad <50 años, la duración de los síntomas previo al inicio del tratamiento ≤3 meses, una buena función neurológica, buen performance status, resección quirúrgica máxima y tratamiento con radioterapia con intención radical (DT 54 Gy). La supervivencia mediana según dicha clasificación pronóstica puede variar desde 5 años (clase I) a 1,5 años (clase III).
TRATAMIENTO INICIAL
Hasta hace muy poco los ensayos clínicos incluían astrocitomas grado III y grado IV como gliomas malignos, y la mayoría de los datos referentes al tratamiento de los AA provienen de resultados del análisis por subgrupos de dichos ensayos, y por lo tanto son resultados poco consistentes. El tratamiento inicial común a todas las lesiones tumorales de alto grado es la cirugía. Debe ser lo más radical posible, pero preservando el estado neurológico del paciente, dado que una resección completa de este tipo de tumores infiltrantes es virtualmente imposible. En cualquier caso, las recurrencias tumorales aparecen habitualmente próximas a la cavidad de la resección previa.
El tratamiento radioterápico ha sido la base en el tratamiento de los gliomas malignos durante los últimos 25 años. Dos estudios realizados por el Brain Tumor Study Group (BTSG) en 1978 y 1980 demostraron un aumento de la mediana supervivencia con el tratamiento radioterápico post-quirúrgico en gliomas malignos (grado III y grado IV) de 4 a 8 meses, y un aumento del número de pacientes vivos a los 18 meses del 10% al 15-20% (Walker et al; 1978 y 1980). Tras varios estudios de búsqueda de dosis realizados en los años 80 se definió como tratamiento estándar, para pacientes con un adecuado estado general, la administración de una dosis total de radioterapia de 60 Gy en 30 fracciones diarias tras la cirugía en gliomas de alto grado (AA y GB) (Bleehen et al; 1991).
Se desconoce si el AA puede beneficiarse del mismo enfoque terapéutico que el GB (quimio-radioterapia adyuvante post-quirúrgica o régimen de Stupp). Los pacientes con AA son más jóvenes en general que los pacientes con GB y además tienen una supervivencia superior tratados únicamente con radioterapia. Un estudio publicado por Levin et al. (Levin et al. 1990) en el que se aleatorizaban pacientes con diagnóstico de AA o GB a recibir BCNU o poliquimioterapia (PCV: procarbacina, CCNU y vincristina) adyuvante a la RT, demostró un aumento significativo de la supervivencia para el subgrupo de AA tratado con PCV. Posteriormente, un análisis retrospectivo de 432 pacientes publicado por Prados et al. reveló resultados contradictorios respecto al beneficio de la quimioterapia adyuvante en AA (Prados et al; 1999). En el ensayo fase III randomizado prospectivo realizado por el United Kingdom Medical Research Council, diseñado para establecer el papel de la quimioterapia PCV adyuvante en gliomas malignos (Medical Research council Brain tumor Working Party; 2001), se incluyeron un 17% de AA y no se demostró ningún beneficio significativo a favor de la quimioterapia adyuvante en ningún subgrupo de pacientes. La temozolomida (TMZ) ha demostrado tener actividad antitumoral en AA recurrentes con una toxicidad mínima (Yung et al; 1999); ello ha estimulado que se extrapolaran los resultados del GB al AA y que en algunos centros se emplee el mismo tratamiento. Sin embargo, no existe evidencia del beneficio del régimen de Stupp en dichos pacientes y es demasiado pronto para conocer los efectos a largo plazo del tratamiento concurrente radio-TMZ en una población con una supervivencia mayor. Un nuevo ensayo intergrupo EORTC-NCI Canadá probablemente resolverá esta cuestión: los pacientes con AA sin un perfil molecular de oligodendroglioma serán aleatorizados a recibir o no TMZ concomitante y adyuvante en un esquema de 4 brazos. Se valorará el beneficio de la quimioterapia y el beneficio del tratamiento concurrente y adyuvante. Hasta el momento, fuera de un ensayo clínico, el único tratamiento estándar adyuvante a la cirugía en AA es la radioterapia.
TRATAMIENTO DE LAS RECURRENCIAS
Algunos pacientes presentan una recurrencia local en los bordes del tumor resecado previamente. En dichos casos se puede plantear un tratamiento localizado: cirugía, cirugía con aplicación de polímeros de BCNU (Brem et al; 1995) o re-irradiación local en pacientes seleccionados (Combs et al; 2008). En el tratamiento de las recurrencias irresecables, además del beneficio obtenido con la temozolomida en sus diferentes esquemas de administración (dosis estándar (Stupp et al; 2007), dosis extendidas/densas (Neyns et al; 2008) o dosis intensas (Perry et al; 2010), en el estudio publicado por Vredemburg et al, en el que se demuestra la actividad antitumoral del tratamiento con un fármaco antiangiogénico (bevacizumab) asociado a la quimioterapia convencional (irinotecan o CPT-11) en pacientes con glioma maligno recurrente, se incluyeron un 22% de AA (Vredenburgh et al; 2007). Dichos resultados publicados en 2007 dieron pie a la elaboración de varios estudios con bevacizumab e irinotecan como tratamiento de pacientes con AA con progresión tras temozolomida (Desjardins et al; 2008, Chamberlain et al; 2009). En todos ellos se confirma la eficacia antitumoral y la escasa toxicidad de la combinación.
BIBLIOGRAFÍA
Bleehen NM, Stenning SP. (1991). A Medical Research Council trial of two radiotherapy doses in the treatment of grades 3 and 4 astrocytoma. The Medical Research Council Party. Br J Cancer. 64:769-774.
Brem H, Piantadosi S, Burger PC, Walker M, Selker R, Vick NA, Black K, Sisti M, Brem S, Mohr G, et al. (1995). Placebo-controlled trial of safety and efficacy of intraoperative controlled delivery by biodegradable polymers of chemotherapy for recurrent gliomas. The Polymer-brain Tumor Treatment Group. Lancet. 345:1008-1012.
Combs SE, Bischof M, Welzel T et al. (2008). Radiochemotherapy with temozolomide as re-irradiation using high precision fractionated stereotactic radiotherapy (FSRT) in patients with recurrent gliomas. J Neurooncol. 89: 205-210.
Chamberlain MC, Johnston S. (2009). Salvage chemotherapy with bevacizumab for recurrent alkylator-refractory anaplastic astrocytoma. J Neurooncol. 91: 359-367.
Desjardins A, Reardon DA, Herndon JE 2nd, Marcello J, Quinn JA, Rich JN, Sathornsumetee S, Gururangan S, Sampson J, Bailey L, Bigner DD, Friedman AH, Friedman HS, Vredenburgh JJ. (2008). Bevacizumab plus irinotecan in recurrent WHO grade 3 malignant gliomas. Clin Cancer Res. 14: 7068-7073.
Hardell L, Mild KH, Carlberg M. (2002). Case control study on the use of cellular and cordless phones and the risk for malignant brain tumors. Int J Radiat Biol. 78: 931-936.
Heineman Ef, Cocco P, Gomez MR, et al. (1994). Occupational exposure to chlorinated aliphatic hydrocarbons and risk of astrocytic brain cancer. Am J Inter Med. 26: 155-169.
Levin VA, Silver P, Hannigan J, et al. (1990). Superiority of post-radiotherapy adyuvant chemotherapy with CCNU, procarbazine o vincristine (PCV) over BCNU for anaplastic gliomas: NCOG 6G61 final report. Int J Radiat Oncol Biol Phys. 18: 321-324.
Medical Research council Brain tumor Working Party. (2001). Randomized trial of procarbazine, lomustine and vincristine in the adjuvant treatment of high-grade astrocytoma: a Medical Research Council Trial. J Clin Oncol. 19:509-518.
Neyns B, Chaskis C, Joosens E, Menten J, D'Hondt L, Branle F, Sadones J, Michotte A. (2008). A multicenter cohort study of dose-dense temozolomide (21 of 28 days) for the treatment of recurrent anaplastic astrocytoma or oligoastrocytoma. Cancer Invest. 26: 269-77.
Perry JR, Bélanger K, Mason WP, Fulton D, Kavan P, Easaw J, Shields C, Kirby S, Macdonald DR, Eisenstat DD, Thiessen B, Forsyth P, Pouliot JF. (2010). Phase II trial of continuous dose-intense temozolomide in recurrent malignant glioma: RESCUE study. J Clin Oncol. 28: 2051-7.
Prados MD, Scott C, Curran WJ, et al. (1999). Procarbazine, lomustine and vincristine (PCV) chemotherapy for anaplastyc astrocytoma: a retrospective review of radiation therapy oncology group protocols comparing survival with carmustine or PCV adyuvant chemotherapy. J Clin Onco. 17: 3389-3395.
Sant M, Allemani C, Santaquilani M, Knijn A, Marchesi F, Capocaccia R; EUROCARE Working Group. (2009). EUROCARE-4. Survival of cancer patients diagnosed in 1995-1999. Results and commentary. Eur J Cancer. 45: 931-991.
Scott CB, Scarantino C, Urtasun R, et al. (1998). Validation and predictive power of Radiation Therapy Oncology Group (RTOG) recursive partitioning analysis classes for malignant glioma patients: a report using RTOG 90-06. Int J Radiat Oncol Biol Phys. 40: 51-55.
Stupp R, Reni M, Gatta G, Mazza E, Vecht C. (2007). Anaplastic astrocytoma in adults. Crit Rev Oncol Hematol. 63: 72-80.
Vredenburgh JJ, Desjardins A, Herndon JE 2nd, Dowell JM, Reardon DA, Quinn JA, Rich JN, Sathornsumetee S, Gururangan S, Wagner M, Bigner DD, Friedman AH, Friedman HS. (2007). Phase II trial of bevacizumab and irinotecan in recurrent malignant glioma. Clin Cancer Res. 13: 1253-1259.
Walker MD, Alexander Jr E, Hunt WE, et al. (1978). Evaluation of BCNU and/or radiotherapy in the treatment of anaplastic gliomas. Acooperative clinical trial. J Neurosurg. 49: 333-343.
Walker MD, Green SB, Byar DP, et al. (1980). Randomized comparisons of radiotherapy and nitrosoureas for the treatment of malignant glioma after surgery. N Engl J Med. 303: 1323-1329.
Yung WK, Prados MD, Yaya-Tur R, et al. (1999). Multicenter phase II trial of temozolomide in patients with anaplastic astrocytoma or anaplastic oligoastrocytoma at first relapse. Temodal brain tumor group. J Clin Oncol. 17: 2762-2771.
- 169711 lecturas