Gliomatosis Cerebri
RESUMEN
La gliomatosis cerebri (GC) es una entidad heterogénea, que consiste en la infiltración cerebral difusa por células gliales, con afectación de al menos tres lóbulos cerebrales. Dichas células pueden ser astrocitarias, oligodendrogliales o mixtas, y actualmente se clasifica como grado III de la OMS. El pico de máxima incidencia de esta entidad ocurre entre los 40 y 50 años. Los síntomas de GC suelen ser inespecíficos (siendo el más frecuente las crisis comiciales). La RM craneal constituye el gold standard en el diagnóstico. Son particularmente importantes las secuencias T2/FLAIR, más sensibles para identificar la extensión de la infiltración tumoral. Habitualmente existe afectación bilateral y/o de la sustancia gris, y en ocasiones extensión al tronco cerebral, cerebelo e incluso la médula espinal. Se han descrito dos tipos de GC: GC primaria (tumor glial infiltrante difuso desde el inicio), y GC secundaria (tumor glial preexistente con progresión posterior siguiendo un patrón radiológico de GC).
Siempre que sea posible será necesaria una confirmación histológica. No existe una alteración molecular específica de esta entidad. En lo que respecta al abordaje terapéutico, tanto la radioterapia (RT) como la quimioterapia (QT) mejoran los síntomas y la supervivencia, y estudios recientes apoyan iniciar el tratamiento con QT. La supervivencia es variable según las series (mediana 14,5 meses) reflejando la heterogeneidad de esta enfermedad. Varios estudios han demostrado el papel pronóstico de factores clásicos como la edad, KPS, histología, y captación de contraste. La histología oligodendroglial, la presencia de la deleción 1p/19q y la afectación de la sustancia blanca confieren quimiosensibilidad y mejor pronóstico. Son necesarios estudios multicéntricos para poder avanzar en el conocimiento y mejorar la supervivencia de estos pacientes.
INTRODUCCIÓN
La gliomatosis cerebri (GC) es una entidad heterogénea, con una historia natural mal definida, cuyas primeras descripciones, procedentes de series necrópsicas datan de principios del siglo XX (Nevin; 1938). La última actualización de la OMS la define como una infiltración glial difusa (usualmente astrocitaria) del sistema nervioso central, que afecta al menos a tres lóbulos cerebrales, con preservación de la arquitectura. Habitualmente existe afectación bilateral y/o de la sustancia gris, y en ocasiones extensión al tronco cerebral, cerebelo e incluso la médula espinal (Fuller et al; 2007). Los datos epidemiólogicos más recientes apuntan a que el pico de máxima incidencia de esta entidad ocurre entre los 40 y 50 años, con una ratio similar entre hombres y mujeres. Con mayor frecuencia las células que componen el tumor son de estirpe astrocitaria (Taillibert et al; 2006).
DIAGNÓSTICO
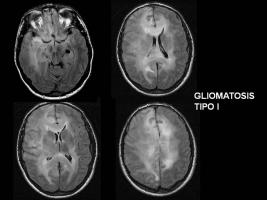
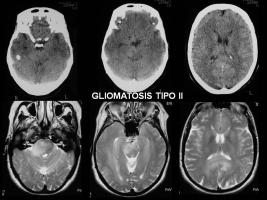
El proceso diagnóstico debe basarse en la anamnesis, exploración neurológica, exploración neuro-psicológica, y la RM craneal (son particularmente importantes las secuencias T2/FLAIR, más sensibles para identificar la extensión de la infiltración tumoral). Siempre que la localización de las lesiones y la situación clínica del paciente lo permitan, debe realizarse una biopsia que permitirá la confirmación histológica, y aportará material para estudios moleculares. Los criterios diagnósticos son la infiltración difusa de al menos tres lóbulos en RM en secuencias T2 y/o FLAIR, con ausencia de masa identificable y de de captación de contraste (o zonas < de 1cm). Se han descrito dos tipos de GC (Sanson et al; 2004):
MANIFESTACIONES CLÍNICAS
Los síntomas y signos neurológicos son inespecíficos y dependerán de las localizaciones afectadas. Típicamente el periodo de latencia entre la aparición de la clínica y el diagnóstico suele ser largo.
Los síntomas más frecuentes son: (Jennings et al; 1995, Taillibert et al; 2006):
Las localizaciones más frecuentemente descritas son (Jennings et al; 1995, Vates; 2003):
NEUROIMAGEN
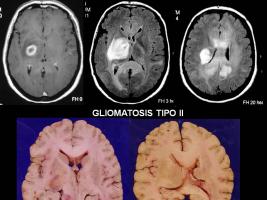
La RM es la exploración radiológica más importante en la GC. Las características radiológicas más frecuentes en la RM, aunque no patognomónicas, son la infiltración en forma de lesión hiperintensa en T2 y FLAIR tanto de la sustancia blanca (SB) como de la sustancia gris (SG) (19%, predomina SB), la infiltración (swelling) del cuerpo calloso, el colapso de las astas ventriculares, la pérdida de los límites entre SG y SB, el engrosamiento cortical, la afectación de los ganglios de la base y la infrecuente captación de contraste. Se han publicado así mismo experiencias con otras técnicas como la espectroscopia (Essig et al; 2001, Yang et al; 2002, Saraf-Lavi; 2003).
TRATAMIENTO
No existe tratamiento estándar para la GC. Las evidencias de las que se dispone habitualmente proceden de series retrospectivas. Respecto a la cirugía, su papel está limitado al diagnóstico histológico y la obtención de material para estudios moleculares. El abordaje terapéutico se basa por tanto, en el tratamiento de soporte (corticoides, anticomiciales, etc) y en el tratamiento específico antitumoral (radioterapia y quimioterapia) (Elshaikh et al; 2002, Sanson et al; 2004, Levin et al; 2004). La radioterapia (RT) se asocia a una mejoría o estabilización de la clínica neurológica en 50-70%, con respuestas radiológicas en torno al 30%. En el 50% la mejoría clínica dura ≥6 meses. No hay evidencia de que administrar dosis > 54 Gy sea más eficaz. La mediana de supervivencia tras la RT es de aproximadamente 11-38 m (Cozard; 1996, Perkins; 2003, Vates; 2003, Horst; 2000). [Resultados RT en GC.jpg].
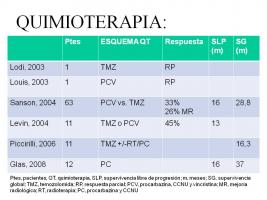
Debido al riesgo de leucoencefalopatía secundaria a la irradiación y el consiguiente deterioro cognitivo, se ha explorado en varios estudios el papel de la quimioterapia (QT) de inicio en el manejo de esta entidad [Resultados QT en GC.jpg].
Diferentes esquemas, tanto con PCV (procarbazina, CCNU y vincristina) como con temozolomida han mostrado tasas de respuesta similares (en torno al 26%-45% de respuestas objetivas con supervivencia libre de progresión de 13-16 meses y mediana de supervivencia de 29 meses), encontrando diferencias significativas en el perfil de toxicidad hematológica, siendo mejor tolerados los esquemas basados en temozolomida (Levin et al; 2004, Sanson et al; 2004, Glas et al; 2008). Se han publicado en la literatura experiencias aisladas preliminares con estrategias antiangiogénicas para el manejo de esta entidad. (Seiz et al; 2009).
PRONÓSTICO
Los factores asociados con buen pronóstico en la GC son la edad joven, buen KPS, bajo grado histológico, subtipo histológico oligodendroglial, y la ausencia de captación de contraste (Taillibert et al; 2006). La ausencia de la deleción de 1p/19q, y la afectación de la sustancia gris se han relacionado con quimiorresistencia y peor pronóstico (Kaloshi et al; 2008, Kaloshi et al; 2009).
BIBLIOGRAFÍA
- 38542 lecturas