Tumores Meníngeos: Tumores de Células Meningoteliales
RESUMEN
Los meningiomas suponen globalmente entre el 13 y el 26% de los tumores intracraneales primarios. Son algo más frecuentes en mujeres que en varones (1:1,4) y su incidencia aumenta a lo largo de la vida, representando menos del 2% de los tumores intracraneales pediátricos. Se acepta que su origen son las células aracnoideas de las vellosidades. Se presentan con mayor frecuencia en los bordes de los senos durales, en torno a la salida de los pares craneales, la placa cribiforme y la fosa meníngea media. También pueden originarse a partir de las células meningoteliales del plexo coroideo y la tela coroidea. Dentro de la clasificación de la OMS, los meningiomas se dividen en grado I, grado II o atípico y grado III o anaplásico. Se describen además variantes histológicas, siendo las más comunes el meningioma meningotelial, fibroblástico y transicional.
El tratamiento fundamental de los meningiomas es la extirpación quirúrgica, pudiendo lograrse la curación definitiva si se extirpa en su totalidad el tumor y su base de implantación en la duramadre. Las recurrencias son más probables cuanto menor sea el grado de extirpación. Como alternativa a la cirugía se puede plantear el tratamiento radioterápico, bien como dosis única (radiocirugía), como radioterapia con fraccionamiento convencional, o como radioterapia estereotáctica fraccionada. La radioterapia puede utilizarse también como tratamiento combinado con la cirugía cuando no se consigue resección completa de la lesión, o en caso de progresión. En algunos casos, puede optarse únicamente por observación clínica y radiológica (por ejemplo, tumores asintomáticos y de pequeño tamaño en pacientes mayores).
El meningioma atípico o grado II presenta características histológicas de cierta agresividad histológica y una mayor tendencia a la recidiva. Supone entre el 5 y el 15% de los meningiomas. El meningioma anaplásico o grado III es aún menos frecuente. Presenta características de malignidad franca, con necrosis e índice mitótico muy alto. Su pronóstico es claramente peor.
INTRODUCCIÓN
El meningioma es un tumor bien conocido, descrito ya por Cushing y Eisenhart en 1938 (Cushing et al.; 1938). Para el lector interesado en profundizar en el tema, existe una excelente y pormenorizada descripción de los diversas localizaciones de meningioma y sus comportamientos en el libro de Al Mefty (Al Mefty; 1991).
Se acepta que su origen son las células aracnoideas de las vellosidades. Por ello se presentan con más frecuencia en los bordes de los senos durales y las granulaciones que presentan alrededor, así como en torno a la salida de los pares craneales, la placa cribiforme y la fosa meníngea media. También las células meningoteliales del plexo coroideo y la tela coroidea pueden dar origen a meningiomas.
Son algo más frecuentes en mujeres que en varones (1:1,4) y su incidencia aumenta a lo largo de la vida. Representan menos del 2% de los tumores intracraneales pediátricos. Globalmente suponen entre el 13 y el 26% de los tumores intracraneales primarios.
Se han descrito anomalías genéticas en los meningiomas, siendo la más frecuente la monosomía del cromosoma 22. Es frecuente la presencia de meningiomas múltiples en pacientes con neurofibromatosis tipo 2 (NF-2), asociada con una mutación o pérdida en 22q.
Aproximadamente dos tercios de los meningiomas expresan receptores de progesterona, y raramente de estrógenos. Se ha descrito la aceleración de su crecimiento durante el embarazo y un aumento de su incidencia en mujeres que han recibido sustitutos hormonales tras la menopausia (Benson et al.; 2010).
El meningioma es uno de los tumores que puede presentarse como tumor radioinducido, tanto tras alta como baja dosis de radiación. Estos tumores son con mayor frecuencia multifocales y agresivos [Link a 3.1.2.1.Complicaciones neurológicas de la radioterapia].
HISTOPATOLOGÍA
Dentro de la clasificación de la OMS los meningiomas se incluyen como tumores de células meningoteliales, y se recogen variantes del meningioma. Se agrupan dentro del grado I de la OMS las variantes que se considera que tienen menos riesgo de recidiva, que incluyen: Meningioma Meningotelial, Fibroso o Fibroblástico, Transicional (mixto), Psamomatoso, Angiomatoso, Microquístico, Secretor, Linfoplasmacitoide y Metaplásico.
Macroscópicamente, la mayoría de estos tumores son masas duras con amplia implantación dural. En ocasiones crecen de forma muy alargada sobre la duramadre, denominándose entonces meningioma en placa. Normalmente empujan al parénquima cerebral, del que se mantienen separados por una capa de aracnoides. Puede ocurrir que se produzca la rotura de ese límite y se invada el parénquima cerebral, especialmente en lesiones de gran tamaño y con poca penetración. La vascularización de estos tumores se recibe habitualmente desde la duramadre de la zona de implantación. Los tumores con más tendencia a invadir el parénquima pueden también parasitar los vasos parenquimatosos.
A nivel microscópico, los tipos más comunes son el meningioma meningotelial, fibroso y transicional. Los meningoteliales tienen nucleos ovales uniformes y forman lóbulos rodeados por finos tabiques colágenos. Los fibrosos tienen células fusiformes paralelas que forman haces en una matriz de colágeno o reticulina. Los transicionales tienen características de ambos y son frecuentes los cuerpos de psamoma y los remolinos.
En los últimos años han ganado importancia los estudios inmunohistoquímicos para la confirmación diagnóstica en caso de duda, y para valorar el índice de proliferación del tumor. Los meningiomas típicamente son positivos para vimentina, y la mayoría para EMA; la positividad de este último es menos consistente en los atípicos y anaplásicos. El índice de proliferación medido con anticuerpo MIB-1 frente a ki-67 se correlaciona positivamente con el grado histológico y con el pronóstico, incluyendo meningiomas de todos los grados. Sin embargo, dentro del grado I, los resultados de este índice no establecieron diferencias pronósticas sobre 600 tumores de grado I con resección completa (Roser et al.; 2004).
Las manifestaciones clínicas dependen del sitio de origen y de que son tumores de crecimiento lento; por ello ocasionan fundamentalmente síntomas de compresión. Pueden ser crisis, si crecen sobre zonas más epileptógenas, déficit focales, o síntomas de hipertensión intracraneal los que crecen sobre zonas menos elocuentes. Los de convexidad pueden debutar con crisis o cefalea y hemiparesia de instauración lenta. Los de piso anterior de base de cráneo, pueden producir anosmia, que muchas veces pasa desapercibida y progresar a alteraciones de carácter e hipertensión intracraneal, alcanzando gran tamaño antes del diagnóstico. Si crecen hacia los nervios ópticos producen alteraciones campimétricas con atrofia óptica. Los de seno cavernoso pueden debutar con diplopía. En fosa posterior es frecuente que produzcan un intenso dolor en el cuello y suboccipital seguido lentamente por anomalías sensoriales o motoras en extremidades. No es infrecuente que produzcan un hiperostósis observable por el paciente, a veces años antes de la aparición de síntomas intracraneales [hiperostosis.jpg].
Tras la sospecha clínica, las pruebas de neuroimagen (TC, RM craneal) localizan con facilidad un tumor extraaxial, con una alta probabilidad de encontrar una imagen típica de meningioma que permita sospechar el diagnóstico correcto.
TRATAMIENTO
- Cirugía.
El tratamiento fundamental de los meningiomas es la extirpación quirúrgica. Es posible conseguir la curación definitiva si se extirpa en su totalidad el tumor y su base de implantación en la duramadre. Las recurrencias son posibles con todos los grados de extirpación, pero más probables cuanto menor sea este.
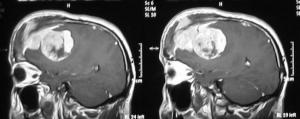
La indicación de cirugía es indiscutible en casos de tumores grandes y sintomáticos, donde no existe alternativa [meningioma.jpg].
En tumores más pequeños, o con pocos síntomas la cirugía sigue siendo la primera opción, pero pueden plantearse otras opciones terapéuticas, o incluso la vigilancia en pacientes mayores o con comorbilidad.
Los principios básicos de esta cirugía son eliminar primero la vascularización del tumor, luego descomprimir el tumor y luego separar el tumor del cerebro con mínima presión sobre el tejido normal. Si se cumplen estas premisas, el tumor suele poder separarse del parénquima, los pares craneales y los vasos sin lesiones, ya que mantiene un plano aracnoideo de separación. Sin embargo, no siempre existe este plano; en algunos casos, especialmente en tumores grandes o atípicos, puede perderse. En algunos de estos casos, puede ser preferible dejar pequeños restos de tumor si hay invasión de la adventicia de ramas arteriales gruesas, pares craneales, o el parénquima de la región del tronco. En los tumores implantados en la base del cráneo o en la pared dural de grandes senos venosos, puede ser más prudente no resecar la base de implantación.
- Tratamientos de soporte.
Aparte de los riesgos propios de cada tumor por su tamaño y localización, es característico de los meningiomas un riesgo elevado de trombosis venosa profunda y tromboembolismo pulmonar (TVP/TEP). Dado que en cirugía cerebral el riesgo de hemorragia es también elevado, no se utiliza profilaxis farmacológica, y sí se recomienda el uso rutinario de dispositivos de compresión neumática, que han demostrado una disminución significativa de la incidencia de TVP/TEP.
Tradicionalmente, se utilizaban anticomiciales profilácticos desde el diagnóstico o desde la cirugía y se mantenían indefinidamente. A partir del año 2000, una recomendación de la Academia Americana de Neurología (Glantz et al.; 2000) ha llevado a revisar esta política, siendo ahora la estrategia habitual no utilizar profilaxis, o mantenerla solo la semana después de la cirugía.
- Radioterapia.
Como alternativa a la cirugía se puede plantear la radiación ionizante, bien como dosis única (radiocirugía), como radioterapia con fraccionamiento convencional, o como radioterapia estereotáctica fraccionada, tema que se trata en detalle en otras partes de este texto [Link a 3.2.3.2.Radioterapia]. En general, la opción de tratamiento con radiación tiene un riesgo inmediato que puede ser menor que el de la cirugía, y una probabilidad de control de la enfermedad que disminuye con el tiempo.
En tumores menores de 10cc o de 2,5 cm de diámetro mayor, la probabilidad de control local es de 80-95%, incluso a 5-10 años. Por ello puede ser una alternativa, especialmente cuando se trata de tumores situados en áreas de riesgo quirúrgico elevado, pacientes con riesgo elevado y pacientes mayores.
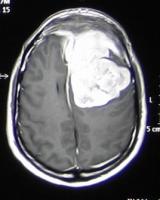
Aparte de la indicación de radiocirugía como alternativa a la cirugía, existe la opción de utilizarla como tratamiento combinado. En casos de tumores grandes en áreas cuya extirpación supone un riesgo de morbilidad añadido, como las áreas de implantación en base de cráneo, o las invasiones de seno cavernoso, la estrategia más adecuada puede ser una extirpación amplia pero subtotal y radiar un resto de pequeño tamaño [meningiomabase.jpg].
Se ha propuesto por varios grupos utilizar radioterapia postoperatoria en todos los casos de resección incompleta, ya que parece que prolonga el intervalo libre de progresión, pero no existe acuerdo unánime.
No existen comparaciones adecuadas sobre los beneficios relativos de cirugía frente a radioterapia/radiocirugía, o radioterapia justo después de cirugía frente a radioterapia solo en la recidiva o progresión.
En algunos casos, los meningiomas que se diagnostican pueden no requerir tratamiento (por ejemplo, tumores asintomáticos y de pequeño tamaño en pacientes mayores), aunque existen incógnitas acerca de la historia natural de estos tumores. A veces el seguimiento radiológico anual puede mostrar lesiones que no progresan o que lo hacen a una velocidad no preocupante para la expectativa de vida del enfermo.
La quimioterapia se considera en general ineficaz en los meningiomas. Se describió hace unos años la utilización de hidroxiurea pero los resultados favorables iniciales no se han confirmado en posteriores estudios (Newton; 2007).
PRONÓSTICO
Tras extirpaciones amplias, una mayoría de los tumores no recidiva. En caso de que quede tumor residual, las probabilidades de recurrencia van aumentando con los años. Es difícil predecir la evolución de un caso concreto, ya que existe una variabilidad muy grande en el comportamiento de histologías similares. En uno de los seguimientos más largos realizados se encontró que en meningiomas de base de cráneo, a más de 10 años, la enfermedad había progresado en todos los pacientes con extirpaciones incompletas y un 16% de las completas (Mathiesen et al.; 1996). Estos autores recomendaron mantener los seguimientos periódicos con imagen hasta 20 años. Una serie del año 2010 encontró tasas de supervivencia libre de progresión a 5 años de 95, 85, 88, y 81%, según el grado de resección realizado (Sughrue et al.; 2010).
MENINGIOMA ATÍPICO GRADO II
El meningioma atípico representa una variante del meningioma en el que se asocian características histológicas de cierta agresividad histológica con una mayor tendencia clínica a la recidiva. Supone entre el 5 y el 15% de los meningiomas (Bruna et al.; 2007).
El diagnóstico es controvertido, ya que los criterios varían ligeramente de unas clasificaciones a otras. El origen de esta variación es que no existe realmente una separación neta entre el meningioma grado I y el grado II, y ninguna clasificación delimita de forma perfecta dos grupos pronósticos. El meningioma atípico se caracteriza por la presencia de una actividad mitótica más elevada, mayor densidad celular, un cociente núcleo/citoplasma mayor, y posible aparición de focos de necrosis.
Dentro de los tumores de origen meningotelial, la OMS incluye en su clasificación un grado II que incluye además del meningioma atípico otros tipos histológicos que tienen en común un mayor riesgo de recurrencia y la posibilidad de una progresión más rápida. Estos tipos son el Meningioma Cordoide y el Meningioma de células Claras. Todos estos tumores son menos frecuentes que el meningioma grado I, por lo que la información clínica es escasa.
Tanto el meningioma atípico como el anaplásico pueden presentarse con este aspecto desde el principio, o en la recidiva de un meningioma inicialmente típico. Ambos son más frecuentes entre los tumores radioinducidos. La progresión de meningioma grado I a grado II se asocia a pérdidas cromosómicas en 1p, 6q, 10q, 14q y 18q, y a ganancias en 1q, 9q, 12q, 15q, 17q y 20q.
BIBLIOGRAFÍA
Aghi, M.K., Carter, B.S., Cosgrove, G.R., Ojemann, R.G., Amin-Hanjani, S., Martuza, R.L., Curry, W.T.,Jr & Barker, F.G.,2nd (2009). Long-term recurrence rates of atypical meningiomas after gross total resection with or without postoperative adjuvant radiation. Neurosurgery.64:56-60; discussion 60.
- 97927 lecturas