Glioblastoma (grado IV)
RESUMEN
El glioblastoma (GB) es el tumor primario cerebral más frecuente y el más agresivo. Su incidencia es de 3-4 casos por 100.000 habitantes por año. Es más frecuente en adultos, siendo la edad media al diagnóstico de 62 años. Es un tumor infiltrativo que se localiza preferentemente en la sustancia blanca de los hemisferios cerebrales. La mayor parte de los GB surgen ‘de novo’, sin que exista evidencia de una lesión precursora previa (GB primarios). Por el contrario, los GB secundarios se desarrollan a partir de astrocitomas de menor grado. La sintomatología de los GB depende de su localización. Los síntomas de presentación más frecuentes son cefalea, crisis comiciales, y síntomas de vías largas (alteraciones motoras y/o sensitivas). La realización de pruebas de imagen, en particular la RM cerebral, es fundamental para confirmar la sospecha clínica y caracterizar adecuadamente la lesión, lo que permitirá establecer la indicación quirúrgica. El diagnóstico de certeza se obtiene mediante la obtención de material histológico. El GB se caracteriza histológicamente por presentar proliferación microvascular y/o necrosis, además de atipia nuclear y actividad mitótica elevada. El tratamiento habitual incluye la combinación de cirugía, radioterapia y quimioterapia. El objetivo de la cirugía es confirmar el diagnóstico y lograr la máxima resección del tumor, manteniendo al mismo tiempo la mejor función neurológica posible. Sin embargo, por definición, la cirugía nunca es radical en el GB, debido a la naturaleza infiltrante del tumor. El tratamiento estándar postquirúrgico consiste en la combinación de radioterapia externa fraccionada (dosis total de 60 Gy), asociada a tratamiento concomitante y secuencial con quimioterapia (temozolomida). La mediana de supervivencia con este tratamiento es de 14,6 meses, frente a 12,1 meses solo con radioterapia. Los pacientes que presentan determinada alteración molecular en el tejido tumoral (metilación del promotor del gen MGMT tienen mejores resultados. Un 30% de los pacientes tratados con radioquimioterapia desarrollan una falsa progresión clínica o radiológica reversible que ocurre típicamente de 1-3 meses tras el tratamiento concomitante (“pseudoprogresión”). Su aparición se ha relacionado con un aumento de supervivencia, y es más frecuente en los pacientes que presentan metilación de MGMT. El 95% de pacientes con GB presentarán progresión de su enfermedad. El tratamiento de la recurrencia puede incluir, según los casos, una nueva cirugía, re-irradiación y/o tratamientos quimioterápicos de segunda línea (nitrosoureas, pautas alternativas de TMZ, bevacizumab).
Se desconoce la causa del desarrollo de los gliomas [Link a 3.2.1.1.3. Epidemiología Analítica (factores de riesgo)]. Se ha detectado una tendencia al alza de la incidencia de gliomas de alto grado que no se justifica exclusivamente por el aumento de la esperanza de vida de la población. Algunos síndromes familiares se han relacionado con un aumento de la frecuencia de los gliomas. No se ha demostrado una relación con la telefonía móvil.
HISTOPATOLOGÍA
La mayoría de patólogos utilizan la última revisión (2007) de los criterios de la Organización Mundial de la Salud (OMS) (Louis et al; 2007). El GB se caracteriza histológicamente por presentar además de atipia nuclear y actividad mitótica (rasgos que definen a los astrocitomas grado II y III respectivamente), proliferación microvascular y/o necrosis. El GB se localiza preferentemente en los hemisferios cerebrales. La mayor parte surgen ‘de novo’, sin que exista evidencia de una lesión precursora previa, y son los denominados GBs primarios. Los GBs secundarios se desarrollan a partir de astrocitomas de menor grado (II o III). A pesar de que morfológicamente son similares, estos dos grupos presentan unas características clínicas y un perfil molecular distinto. Los primeros constituyen el 95% de los GB y presentan una historia natural inferior a 6 meses, con una edad media de presentación de 60 años. Los GBs secundarios representan únicamente el 5% de todos los GBs y proceden de tumores de grado inferior diagnosticados con una mediana de 45 años.
Se han descrito variantes poco frecuentes de GB, algunas con alteraciones moleculares propias. Así se describen GBs de células pequeñas, GBs de células gigantes, GBs con áreas tipo PNET, y gliosarcomas, que se caracterizan por mostrar un patrón bifásico, con focos alternantes de diferenciación glial y mesenquimal. El “GB con componente oligodendroglial” es una entidad controvertida. Representa, en realidad, un tumor mixto de grado IV, donde normalmente se identifica un componente astrocitario grado IV (GB) y áreas de aspecto oligodendroglial. Esta variante muestra un mejor pronóstico que el GB clásico. Ninguna de estas entidades tiene por el momento un tratamiento diferente.
FACTORES PRONÓSTICO
Existen una serie de factores pronóstico que son comunes a todos los gliomas de alto grado:
• Edad (<50 años)
• Índice de Karnofsky (≥70%) o ECOG Performance status (PS) ≥ 2
• Presencia de elementos oligodendrogliales
• Cirugía completa o parcial (versus biopsia)
• Función cognitiva conservada (MMS> 27)
• Metilación del gen promotor de MGMT (factor predictivo de respuesta a agentes alquilantes).
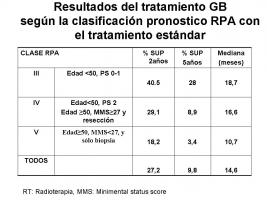
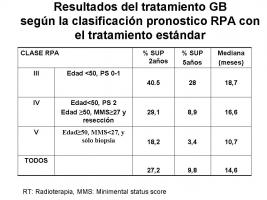
En el GB existe una clasificación pronóstica, basada en Recursive Partitioning Analysis (RPA), descrita hace años (Scott, Scarantino et al.; 1998) y validada recientemente por la European Organization for Research and Treatment of Cancer (EORTC) para el GB (Scott, Scarantino et al.; 1998, Mirimanoff, Gorlia et al.; 2006). Esta clasificación permite identificar a los pacientes que van a beneficiarse del tratamiento oncológico y la comparación de resultados entre los diferentes estudios. Sin embargo, a diferencia de otras enfermedades oncológicas, no permite la selección de tratamiento específico; es decir, que no funciona como una estadificación clínica. [Figura de los resultados según la clasificación RPA.jpg]
En los tumores cerebrales no existe una estadificación clínica validada, dada la interacción entre factores pronóstico como el PS, la edad y el estado neurológico.
MANIFESTACIONES CLÍNICAS
La sintomatología de los tumores cerebrales depende de su localización. Los pacientes pueden presentar cefalea (usualmente matutina), convulsiones, síntomas y signos de vías largas (alteraciones motoras o sensitivas), alteraciones del campo visual, alteraciones del lenguaje, alteraciones de la memoria, cambio de personalidad, síntomas de hipertensión intracraneal (nauseas, vómitos, papiledema y fotofobia), etc. [Link a 3.2.2.1. Diagnóstico Clínico]. Sin embargo, los síntomas más frecuentes son los tres primeros (DeAngelis; 2001). Los pacientes suelen acudir a urgencias debido a un síntoma nuevo que delata la existencia de una lesión y, en ocasiones, en la anamnesis se detecta sintomatología sutil que existía ya desde unos meses antes (por ejemplo cambio conductual, ‘despistes’ etc.).
PRUEBAS COMPLEMENTARIAS
En general los síntomas neurológicos son lo bastante claros para solicitar una tomografía axial computerizada (TAC) que suele ser orientativa del problema del paciente [Link a 3.2.2.2.1.Tomografía Computarizada]. Idealmente debe realizarse a continuación una resonancia magnética (RM) para una mejor caracterización radiológica de la lesión [Link a 3.2.2.2.2. Resonancia magnética] y posteriormente se debe obtener diagnóstico histológico para lograr el diagnóstico de certeza.
- Neuroimagen
La valoración radiológica de la lesión tras su detección consiste en la determinación del número de lesiones, la caracterización de la imagen, la extensión de la afectación y la elocuencia del tejido cerebral subyacente. Todo ello es importante para decidir el tipo de tratamiento quirúrgico que puede realizarse.
La TAC cerebral con contraste suele ser la primera exploración que se realiza al paciente. Se trata de una exploración rápida y barata que usualmente se practica en urgencias. Sin embargo la exploración principal es la RM, cuya sensibilidad es cercana al 100%. La detección de las lesiones se basa en cambios de la morfología y de la señal que provocan tanto el tumor como la reacción del tejido cerebral normal al mismo. Las imágenes obtenidas son debidas con frecuencia a alteraciones de la barrera hematoencefálica (BHE) que permiten el paso de contraste. La imagen del GB es bastante típica: una lesión ocupante de espacio que parece bien delimitada con captación anular y necrosis central en las secuencias T1 con gadolinio, pero que se observa en toda su amplitud con el edema circundante en las imágenes sin contraste T2 y T2/FLAIR [Imagen típica de GBM.jpg].
En el diagnóstico inicial de una lesión de estas características se debe tener en cuenta la edad del paciente, la historia clínica y las características de la imagen (localización y número de lesiones y tipo de alteraciones que se observan en las diversas secuencias T1, T2, T1 con administración de gadolinio, y FLAIR).
En el seguimiento de un GB es importante valorar la relación temporal de la obtención de la imagen con la radioterapia, la cirugía, la radiocirugía, o las dosis de dexametasona que está recibiendo el paciente, ya que todos estos factores pueden modificar el estado de la BHE y la captación de contraste, y en consecuencia el ‘tamaño de la lesión’ evaluado en las secuencias T1 con gadolinio.
Los gliomas suelen presentar zonas con distinta agresividad, y, aunque el realce tras administración de contraste se considera un criterio de sospecha de agresividad, la no captación de contraste no es excluyente, especialmente en las fases precoces.
Otras técnicas de RM como las secuencias de difusión, perfusión, tractografía y espectroscopía han comenzado a introducirse en la evaluación de los pacientes con GB. También se está empezando a utilizar la Tomografía por Emisión de Positrones (PET), que ofrece información fisiológica y bioquímica relacionada con el metabolismo tumoral, la tasa de proliferación y la capacidad de invasión [Link a 3.2.2.2.3. Medicina Nuclear: SPECT y PET]. Todas las técnicas de neuroimagen ayudan a realizar diagnóstico diferencial con otras entidades que pueden presentar imágenes radiológicas similares (abscesos etc.). Sin embargo, el diagnóstico de certeza requiere la obtención de material histológico para el análisis de la lesión. Dado que dicho diagnóstico tiene también una función terapéutica se tratará en el capítulo de tratamiento.
TRATAMIENTO INICIAL
CIRUGÍA
El papel de la cirugía es crucial para obtener el diagnóstico histológico y para lograr una descompresión inmediata del cerebro. Su objetivo principal es conseguir la máxima resección del tumor, manteniendo al mismo tiempo la mejor función neurológica posible para preservar la calidad de vida. La edad del paciente y su estado general (PS) son factores considerados en la selección del tratamiento quirúrgico.
La posibilidad de resección depende de la ‘no localización del tumor en áreas elocuentes’. La exéresis de un área elocuente produciría una pérdida definitiva de la función neurológica correspondiente. En estudios retrospectivos, la radicalidad de la cirugía ha demostrado ser un factor pronóstico en gliomas si la resección es superior al 98% del tumor (Lacroix, Abi-Said et al.; 2001, McGirt, Chaichana et al.; 2008). No es posible realizar estudios aleatorizados sobre el valor de la radicalidad de la cirugía, dado que algunos tumores seguirían siendo irresecables a pesar de una indicación quirúrgica por aleatorización. En los tumores resecables o con posibilidad de resección parcial, los neurocirujanos disponen de nuevas tecnologías como la RM intraoperatoria, la neuronavegación, la inmunofluorescencia y la cartografía cerebral, entre otras, que pueden ‘aumentar la cantidad’ de resección. No todos los centros disponen de dicha tecnología. No obstante, probablemente consiguen aumentar el número de tumores que son seleccionados para una resección a pesar de localizarse en áreas elocuentes del cerebro.
Por definición, la cirugía nunca es radical en el GB, debido a la naturaleza infiltrante del tumor. La supervivencia de un paciente con un GB intervenido de forma ‘radical’ sin tratamiento posterior es de aproximadamente 2 meses.
Debe realizarse una RM en el post-operatorio inmediato (máximo a las 72 horas) tras la resección, pues si se realiza más tarde de dicho periodo los cambios post-quirúrgicos no permiten una evaluación correcta de la enfermedad residual.
El 30% de los pacientes con GB es sólo subsidiario de una biopsia de la lesión, debido a la situación del tumor en áreas elocuentes. Estos pacientes tienen una supervivencia limitada de 6-9 meses, incluso con radio y quimioterapia posterior (Balana, Capellades et al.; 2007).
RADIOTERAPIA
La irradiación ha sido el tratamiento estándar en los gliomas de alto grado durante mucho tiempo. Demostró aumentar la supervivencia de 6 a 8 meses ya en los primeros ensayos (Walker, Alexander et al.; 1978; Kristiansen, Hagen et al.; 1981). La intensificación de la dosis de radiación, los radiosensibilizadores, la radiocirugía, el hiperfraccionamiento etc., no han demostrado mejorar los resultados. La radioterapia postoperatoria (focal, 60Gy, tumor +/- edema con margen) es el tratamiento estándar (Laperriere, Zuraw et al.; 2002). Incluso los pacientes mayores de 70 años con buen estado general se benefician del tratamiento con irradiación. (Keime-Guibert, Chinot et al.; 2007) En pacientes ancianos o muy afectados neurológicamente, pautas de tratamiento más cortas con hipofraccionamiento de dosis (focal, 40Gy) consiguen un efecto paliativo similar, sin afectar la supervivencia (Balana, Capellades et al.; 2007).
La radioterapia en ocasiones no se ofrece a pacientes con ‘solo biopsia’ y con compromiso neurológico importante o con grandes masas tumorales que afectan más de un lóbulo cerebral. El tratamiento neo-adyuvante para reducir el tamaño de la enfermedad podría estar indicado en dichos pacientes, pues algunos estudios fase II muestran resultados interesantes (Brada, Ashley et al.; 2005).
QUIMIOTERAPIA
El papel de la quimioterapia fue cuestionado antes de la disponibilidad de temozolomida (TMZ). Los fármacos habituales tienen dificultades para alcanzar el tumor a niveles terapéuticos efectivos debido a la existencia de la BHE. Las nitrosoureas, que atraviesan la BHE debido a su liposolubilidad, como carmustina (BCNU, lomustina (CCNU), y procarbazina, un agente alquilante que se combina con CCNU y vincristina en el régimen de combinación PCV, han sido ampliamente utilizadas en los gliomas de alto grado. Sin embargo, nunca se ha demostrado en ensayos aleatorizados que las nitrosoureas mejoren la supervivencia. Con BCNU se había observado un aumento de supervivientes a los 18 meses de los pacientes con GB tratados de forma adyuvante (DeAngelis, Burger et al.; 1998). Sin embargo, 3 metaanálisis, uno en 1992, otro en 2003 y el último en el 2007, mostraron un beneficio de supervivencia para los pacientes tratados con quimioterapia tras la cirugía y la irradiación, con un aumento de la supervivencia a los 12 y los 24 meses del 10,1% y el 8,6%, respectivamente y una modesta pero clara disminución del riesgo de muerte del 15%, que se traduce en dos meses de aumento de la mediana de supervivencia para los pacientes tratados con quimioterapia. El beneficio de la quimioterapia se extiende en los metaanálisis a todos los subtipos histológicos, a todos los grupos de edad y a todos los tipos de cirugía (Fine, Dear et al.; 1993, Stewart; 2002, Spiegel, Esrailian et al.; 2007).
Desde el año 2005 en que se publicaron los resultados del estudio internacional de la EORTC-NCI Canadá, el tratamiento estándar del GB es la irradiación a dosis de 60 Gy con temozolomida (TMZ) administrada por vía oral diariamente durante 42 (o hasta 49) días y posteriormente 6-12 ciclos de TMZ a dosis de 150-200 mg/m2/d durante 5 días cada 28 días (Stupp, Mason et al.; 2005). Se recomienda profilaxis para las infecciones oportunistas facilitadas por la linfopenia secundaria a la TMZ y a los corticoides. La mediana de supervivencia según los resultados del estudio fue de 14,6 meses con el tratamiento, frente a 12,1 meses si no se añade la quimioterapia a la radioterapia. Los resultados tras 5 años de seguimiento siguen confirmando un beneficio en supervivencia para el grupo de pacientes tratados con TMZ, y también cuando se subclasifican según los grupos pronóstico de la RPA (Stupp, Hegi et al.; 2009). [Figura de los resultados según la clasificación RPA.jpg].
La TMZ es un derivado de segunda generación de la imidazoltetrazinona, que es hidrolizada espontáneamente bajo condiciones fisiológicas en el metabolito activo y actúa como un agente metilador de ADN. Se administra oralmente y penetra la BHE.
Se sabe que las células que tienen la capacidad de reparar el ADN metilado a ADN no metilado mediante, entre otras enzimas, su riqueza en la enzima O-6-metil-guanina-ADN-metil-transferasa (MGMT), pueden superar la lesión de ADN producida por TMZ y por lo tanto no entrar en apoptosis. La enzima es codificada por el gen MGMT. MGMT puede estar metilado en los islotes CpG del promotor del gen y no transcribirse correctamente, lo que causa una inactivación de la enzima. Los pacientes que presentan dicha alteración en el gen MGMT (metilación del promotor) alcanzan mejores resultados, por lo que se considera un factor predictivo de respuesta a la TMZ (Hegi, Diserens et al.; 2005). Sin embargo, no es un parámetro útil hoy por hoy para discriminar a los pacientes con peor respuesta y decidir un tratamiento diferente.
TRATAMIENTOS INTRACAVITARIOS
Otra modalidad de tratamiento aceptada en el GB es el tratamiento local con agentes aplicados en la cavidad de resección tras una cirugía radical. El único aprobado en nuestro país es GliadelR. Se trata de obleas impregnadas de carmustina que se colocan en la cavidad quirúrgica y difunden en los bordes de la cavidad. Se han publicado dos ensayos fase III comparando dicho tratamiento con radioterapia posterior frente a radioterapia exclusiva (Valtonen, Timonen et al.; 1997, Westphal, Hilt et al. 2003), con resultados positivos en supervivencia, pero no se ha comparado nunca con el tratamiento que se considera estándar (radioterapia y TMZ). Sólo el 25% de pacientes pueden beneficiarse de dicho tratamiento. Son aquellos con enfermedad localizada en área no elocuente y candidatos a resección radical (Whittle, Lyles et al.; 2003). Tampoco existen estudios que relacionen la efectividad de dicho tratamiento con el estado del gen MGMT. Este tratamiento produce un discreto aumento de complicaciones post-quirúrgicas (infección local, aumento de crisis comiciales, edema, etc), incluso en manos experimentadas. Sin embargo, sí ha demostrado beneficio cuando se ha revisado retrospectivamente en metaanálisis (Spiegel, Esrailian et al.; 2007) y es posible que tenga un papel en pacientes seleccionados, al disminuir el efecto presumiblemente perjudicial de la ‘ventana’ temporal entre la intervención quirúrgica y el inicio de la radioterapia (Perry, Chambers et al.; 2007). El seguimiento radiológico de los pacientes tratados con carmustina intracavitaria es más complicado, pues produce cambios que dificultan la distinción radiológica entre necrosis o recidiva (Kleinberg, Weingart et al.; 2004).
Otros fármacos intracavitarios están en estudio: los sistemas de convección utilizan la infusión local a presión positiva que optimiza la distribución de fármacos y se están estudiando en ensayos fase III otras moléculas con actividad biológica o moduladora de la inmunidad, además de otros quimioterápicos preparados para la difusión local.
TRATAMIENTO DE SOPORTE [Link a 3.2.3.5. Tratamiento Sintomático]
- Corticoides: La dexametasona se utiliza para disminuir el edema y mejorar los síntomas neurológicos. La dosis utilizada debe ser siempre la mínima necesaria, para evitar los efectos secundarios a largo plazo de los corticoides (hiperglucemia, cushing yatrógeno, miopatía, osteoporosis, fragilidad capilar, etc). Suelen ser necesarios durante la radioterapia (aunque no siempre) y tras la misma para evitar la sintomatología aguda secundaria. Posteriormente deben reducirse las dosis a la mínima dosis posible y si es posible, retirarlos cuanto antes.
- Anticomiciales: No existe evidencia de la utilidad de los anticomiciales como profilaxis primaria en pacientes que nunca han presentado crisis. En general se utilizan durante la primera semana post-cirugía y posteriormente se retiran si el paciente no ha presentado crisis. En cualquier caso, se recomiendan los anticomiciales que no producen interferencias con otros fármacos (no inductores del citocromo hepático cp450). Ejemplos de estos fármacos son el levetiracetam, la gabapentina y el ácido valproico.
PSEUDOPROGRESIÓN:
Se define como una falsa progresión clínica o radiológica que es reversible con tratamiento activo (dexametasona +/-manitol), y que ocurre de 1-3 meses tras el tratamiento concomitante (de Wit, de Bruin et al.; 2004, Brandsma, Stalpers et al.; 2008). Ocurre en el 30% de pacientes (2 de cada 3). No hay ningún método radiológico con suficiente sensibilidad y especificidad por sí mismo para realizar el diagnóstico diferencial con la progresión real de la enfermedad. Pueden aparecer incrementos de volumen e incluso nuevas imágenes en la radiología, debidas probablemente a los cambios en la BHE que permiten el paso de contraste y mayor captación de gadolinio. Ante la aparición de estos cambios radiológicos inmediatamente tras el tratamiento inicial es necesario mantener un alto índice de sospecha de pseudoprogresión. En una serie de pacientes que fueron reintervenidos al identificar imágenes sugestivas de progresión se constató la presencia de necrosis en el 50% de los casos (Chamberlain, Glantz et al.; 2007).
La aparición de pseudoprogresión se ha relacionado con un aumento de supervivencia para los pacientes que presentan dicha reacción al tratamiento, y es más frecuente en los que presentan metilación de MGMT (Brandes, Franceschi et al.; 2008). Es decir, la pseudoprogresión parece ser la expresión de la efectividad del tratamiento, y por lo tanto el tratamiento adyuvante con TMZ ha de continuar. Debido a la dificultad para diferenciar radiológicamente este proceso de la progresión real, se recomienda continuar la TMZ adyuvante como mínimo 3 meses y no incluir al paciente en un ensayo clínico, dado que podría confundirse la reversibilidad del cuadro clínico con una respuesta al nuevo tratamiento y sobreestimar su efectividad.
PROGRESIÓN
El 95% de pacientes con GB presentarán progresión o recurrencia de su enfermedad. En dicho caso puede plantearse de nuevo un rescate quirúrgico o una re-irradiación si la recaída es localizada, el estado general lo permite y técnicamente puede realizarse. También es conveniente un cierto periodo libre de enfermedad desde la cirugía inicial (aproximadamente 1 año).
En caso de no cumplir dichos criterios, para el tratamiento de segunda línea disponemos en nuestro país de las nitrosoureas (carmustina y lomustina). En ciertos casos y basándose en ensayos fase II, puede reintroducirse el tratamiento con TMZ a las mismas dosis o en dosificaciones alternativas de intensificación.
Por último, los tratamientos que tienen como objetivo el bloqueo de la angiogénesis en gliomas están adquiriendo gran protagonismo en el tratamiento del GB. Bevacizumab, un anticuerpo monoclonal con actividad anti VEGF (Vascular endotelial growth factor), presente en el GB, ha obtenido la indicación de tratamiento en 24 países del mundo. Los resultados en respuesta radiológica obtenidos con dicho fármaco, que superan con creces los obtenidos con fármacos más convencionales, no fueron suficientes para que la Agencia Europea del Medicamento (EMEA) autorizara el tratamiento con bevacizumab del GB recurrente, ya que en el estudio principal aleatorizado no se incluyó un grupo control (los resultados se compararon con controles históricos). Por lo tanto y en espera de los resultados del ensayo en primera línea con bevacizumab frente a placebo y tratamiento estándar (radioterapia con TMZ), y de algunos estudios que están en curso en segunda línea, el tratamiento con bevacizumab debe administrase como una indicación fuera de ficha técnica (off-label) en nuestro país.
BIBLIOGRAFÍA
- 312636 lecturas