RESUMEN
La forma de expresión más frecuente de neurotoxicidad por quimioterapia sobre el SNC son los cuadros de encefalopatía, que pueden acompañarse de focalidad neurológica y/o crisis. Según su curso clínico puede ser aguda o crónica, produciendo esta última un cuadro de demencia de tipo subcortical. Algunos de los fármacos quimioterápicos y tratamientos de soporte con efecto neurotóxico potencial sobre el SNC se resumen a continuación:
- Cisplatino: hipoacusia neurosensorial, acúfenos, vestibulopatía, signo de Lhermitte, crisis comiciales, infartos isquémicos.
- Carboplatino: encefalopatía.
- Oxaliplatino: ototoxicidad.
- Ifosfamida: encefalopatía (alteración del nivel de conciencia, agitación, síntomas cerebelosos, parkinsonismo y crisis).
- Melfalán: encefalopatía.
- Nitrosoureas: encefalopatía, mielopatía.
- Busulfán: crisis comiciales.
- Metotrexate: meningitis aséptica, mielitis transversa, encefalopatía aguda, subaguda o crónica.
- Citarabina: síndrome cerebeloso agudo, mielopatía, encefalopatía, meningitis aséptica.
- 5-Fluorouracilo: síndrome cerebeloso agudo.
- Fludarabina: encefalopatía, crisis, ceguera cortical, coma.
- Vincristina: neuropatías craneales.
- Etopósido: cefalea, crisis, alteración del nivel de conciencia.
- Ácido trans-retinoico (ATRA): hipertensión intracraneal idiopática.
- Corticoides: síntomas neuropsiquiátricos, miopatía.
- Bevacizumab: leucoencefalopatía posterior reversible.
CLASIFICACIÓN SINDRÓMICA
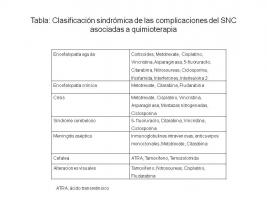
La neurotoxicidad producida por agentes quimioterápicos incluye varios síndromes neurológicos [Clasificación sindrómica de las complicaciones del SNC asociadas a quimioterapia.jpg]. La forma de expresión más frecuente de neurotoxicidad sobre el SNC son los cuadros de encefalopatía.
La encefalopatía por fármacos quimioterápicos cursa con alteración del nivel de conciencia, acompañada o no de focalidad neurológica y, frecuentemente, de crisis. Según su curso clínico puede ser aguda o crónica, produciendo esta última un cuadro de demencia de tipo subcortical.
Mención aparte requieren dos cuadros: la leucoencefalopatía posterior reversible (LPR) y el mutismo acinético. La LPR se caracteriza clínicamente por cefalea, alteración del nivel de conciencia, ceguera cortical y crisis, y por la aparición de lesiones en sustancia blanca de predominio en regiones posteriores del cerebro. El mutismo acinético es una entidad caracterizada por la incapacidad para producir movimientos voluntarios o emitir lenguaje, sin alteración del nivel de conciencia acompañante.
La LPR y el mutismo acinético son entidades descritas con varios fármacos implicados en el tratamiento del cáncer, como son los inhibidores de la calcineurina (ciclosporina y tacrolimus), sirolimus, cisplatino y bevacizumab. Se piensa que ambos cuadros pertenecen a un mismo espectro de alteración en la sustancia blanca cerebral que difieren en la topografía. Se ha descrito la aparición de ambos cuadros de manera simultánea en el mismo paciente, en relación con tratamiento con inhibidores de la calcineurina (Sierra et al.; 2009) [Caso LPR y MA 1.jpg] [Caso LPR y MA 2.jpg] [Caso LPR y MA 3.jpg].
La leucoencefalopatía multifocal progresiva (LMP) es una enfermedad desmielinizante grave del SNC de origen infeccioso, causada por la reactivación del poliomavirus JC. La primoinfección por virus JC suele ocurrir durante la infancia y los anticuerpos son positivos en sangre en un 86% de los adultos. En la mayoría de los individuos, el virus permanece latente en el riñón y en los órganos linfoides, pero, en el contexto de una inmunosupresión celular grave, puede reactivarse y producir daño cerebral con la muerte de los oligodendrocitos (células encargadas de producir la mielina). La clínica consiste en un cuadro subagudo que incluye disminución del nivel de conciencia, paresia, ataxia, síntomas visuales y, en ocasiones, crisis. Su curso clínico suele ser progresivo y fatal. Los estudios de neuroimagen con RM muestran áreas de desmielinización en sustancia blanca multifocales que no siguen un territorio vascular y no presentan efecto masa ni captación de contraste. Algunos fármacos quimioterápicos o inmunosupresores relacionados con este síndrome son rituximab, fludarabina, micofenolato y corticoides, en administración aislada o en combinación con otros fármacos (ciclofosfamida o metrotexate).
CITOSTATICOS
AGENTES ALQUILANTES.
Derivados de platino.
- Cisplatino (cis-diaminodicloroplatino II, CDDP).
El cisplatino es un agente derivado del platino de primera generación. Su mecanismo de acción consiste en insertarse en el ADN celular y producir la apoptosis al interferir en la síntesis del ADN y, por tanto, en la división celular. Se utiliza en el tratamiento de tumores sólidos de ovario, testículo, pulmón y en cáncer de cabeza y cuello. Se administra por vía intravenosa. Es un fármaco muy neurotóxico, especialmente para el SNP, pues atraviesa con dificultad la BHE [Link a 3.1.2.2.2.6.1. Derivados del Platino].
La ototoxicidad es un efecto adverso dosis-dependiente. El cisplatino puede dañar las células ciliadas del Órgano de Corti produciendo sordera neurosensorial a altas frecuencias (>4000 Hz), a veces asociada a acúfenos. La sordera sintomática afecta a un 16-20% de pacientes (especialmente aquéllos tratados con altas dosis por cáncer testicular), aunque la audiometría muestra pérdida de audición en un 74-88% de los pacientes. La dosis acumulada del fármaco, el uso asociado de otros fármacos ototóxicos, la existencia de hipomagnesemia y los antecedentes de trauma acústico son factores de riesgo.
La vestibulopatía con síntomas de vértigo, ataxia y oscilopsia es una complicación infrecuente del tratamiento con cisplatino.
El síntoma de Lhermitte (sensación de “corriente eléctrica” en el cuello o espalda desencadenada por la flexión del cuello) aparece hasta en un 25% de los pacientes tratados con cisplatino. Se produce por una desmielinización de la columna posterior de la médula espinal. Suele resolverse con la interrupción del tratamiento.
El cisplatino puede producir neuropatías ipsilaterales del VII-XII nervios craneales tras su administración intraarterial.
Las complicaciones oftalmológicas son raras: papiledema, neuritis retrobulbar, papilitis y ceguera cortical transitoria. La administración intraarterial proximal al origen de la arteria oftálmica (no en infusión distal a la misma) puede producir isquemia retiniana o neuropatía óptica retrobulbar.
La encefalopatía es una complicación infrecuente y generalmente ocurre con la administración intraarterial del fármaco. Los síntomas incluyen disminución del nivel de conciencia, crisis y déficit neurológicos focales como ceguera cortical.
Las crisis comiciales también pueden ser desencadenadas por anormalidades electrolíticas asociadas al cisplatino, como la hipomagnesemia.
El cisplatino también se ha descrito como posible causa de infartos isquémicos con trombosis arterial, otra causa de ceguera cortical en estos pacientes.
- Carboplatino.
El carboplatino es un derivado del platino de segunda generación, menos neurotóxico que el cisplatino. Tras su administración intraarterial puede producir crisis, infartos, coma y ceguera cortical. La anemia hemolítica trombótica provocada por este fármaco puede ser el origen de déficit neurológicos multifocales con encefalopatía.
- Oxaliplatino.
Se trata de un derivado del platino de tercera generación que se utiliza en el tratamiento del cáncer de ovario y colorrectal. Este fármaco presenta ototoxicidad, aunque menor que el cisplatino.
- Mostazas Nitrogenadas.
- Ifosfamida.
La ifosfamida es un análogo de la ciclofosfamida que se utiliza en el tratamiento del sarcoma y del cáncer de testículo. Puede producir encefalopatía en aproximadamente un 10% de los pacientes tratados con altas dosis. Los síntomas son alteración del nivel de conciencia, agitación, síntomas cerebelosos, parkinsonismo y crisis, y aparecen típicamente en los días 1-4 tras su administración. Generalmente es un cuadro reversible, aunque de forma excepcional puede desembocar en un estado de coma y la muerte del paciente. La insuficiencia renal y hepática son factores predisponentes, así como el tratamiento previo con cisplatino. El tratamiento con azul de metileno o tiamina puede ser útil.
- Ciclofosfamida.
La ciclofosfamida (Cytoxan®) es utilizada en el tratamiento de leucemia linfática, linfoma de Hodgkin y algunos tumores sólidos. A dosis habituales no es neurotóxica, pero a dosis altas puede producir visión borrosa, sensación de mareo y confusión.
- Clorambucilo.
El clorambucilo es un agente alquilante que se utiliza en el tratamiento de síndromes linfoproliferativos, policitemia vera, síndrome nefrótico y cáncer de ovario. Puede producir crisis a altas dosis o en sobredosis accidental. En pacientes con antecedentes de crisis puede inducirlas a dosis habituales. Administrado a dosis habituales puede inducir toxicidad ocular (hemorragias retinianas, queratitis).
- Melfalán.
Con este fármaco se han descrito dos casos de encefalopatía severa tras su administración a dosis altas en dos pacientes con insuficiencia renal.
- Nitrosoureas.
Carmustina (BCNU), lomustina (CCNU) y nimustina (ACNU) son fármacos utilizados en el tratamiento de gliomas cerebrales, melanoma, linfomas y como parte del acondicionamiento en el trasplante de medula ósea. Estos agentes atraviesan fácilmente la BHE porque son muy liposolubles. A dosis convencionales apenas provocan efectos adversos en el SNC, pero pueden provocar una grave encefalopatía asociada o no a mielopatía a altas dosis, o en pacientes que han recibido previamente radioterapia craneal. La ausencia de mejoría de los síntomas tras terapia esteroidea y que no se observe captación de contraste significativa en neuroimagen ayudan a distinguir este cuadro clínico del producido por la progresión del tumor. La administración intracarotídea de BCNU puede provocar pérdida de visión en el ojo ipsilateral en un alto porcentaje de pacientes.
- Temozolomida.
La temozolomida (Temodal®) es un agente alquilante que atraviesa la BHE y cuya biodisponibilidad por vía oral es prácticamente completa. Es muy utilizada en el tratamiento de gliomas malignos: glioblastoma, astrocitoma anaplásico y oligodendroglioma anaplásico. No tiene neurotoxicidad importante. Produce cefalea en al menos un 25% de los pacientes y otros efectos como sensación de mareo, alteración del equilibrio, crisis o somnolencia excesiva.
- Tiotepa.
Este fármaco alquilante se utiliza en el tratamiento del cáncer de mama y de metástasis leptomeníngeas y en el proceso de de preparación para el trasplante de progenitores hematopoyéticos. La neurotoxicidad no es frecuente. Se han descrito en pocos pacientes mielopatía y radiculopatía tras su inyección intratecal. Administrado a dosis altas puede producir encefalopatía, en ocasiones, grave.
- Busulfan.
El busulfán es un agente alquilante cuya administración a altas dosis se utiliza en el acondicionamiento para trasplante de progenitores hematopoyéticos. Este fármaco atraviesa fácilmente la BHE. Las crisis comiciales son frecuentes tras la administración a altas dosis o en el caso de sobredosificación accidental. Pueden aparecer anormalidades electroencefalográficas en ausencia de crisis. Esta complicación puede prevenirse mediante el uso profiláctico de fármacos antiepilépticos o utilizando dosis convencionales del agente quimioterápico.
ANTIMETABOLITOS.
- Metotrexate.
El metotrexate (MTX) es un antagonista del ácido fólico que bloquea el paso de folato a tetrahidrofolato mediante la unión irreversible a la enzima dihidrofolatorreductasa. Se utiliza para el tratamiento de coriocarcinoma, cáncer de mama, linfomas, leucemias y metástasis leptomeníngeas. Este fármaco puede ser administrado por múltiples vías: oral, intravenosa, intraarterial e intratecal.
El efecto adverso más frecuente tras su administración por vía intratecal es la meningitis aséptica, que ocurre en un 10% de los pacientes. La clínica consiste en cefalea, rigidez de nuca, náuseas, vómitos, fiebre y somnolencia. El estudio de LCR muestra moderada pleocitosis y cultivos estériles. Este cuadro aparece pocas horas tras la administración del MTX y generalmente se resuelve en 72 horas. La meningitis aséptica no es una contraindicación para volver a tratar con MTX intratecal.
Una complicación infrecuente y grave del MTX intratecal es la mielitis transversa. Su inicio es variable y su recuperación también. Se cree que es una reacción idiosincrática al fármaco. Esta afectación sí es una contraindicación absoluta para continuar el tratamiento con MTX. La administración intratecal también puede provocar otros efectos adversos menos frecuentes como encefalopatía, crisis, neuropatías craneales y radiculopatía lumbosacra.
La administración sistémica de MTX puede producir encefalopatía aguda, subaguda o crónica. La primera de ella generalmente es reversible y se resuelve en pocos días, pudiendo continuarse el tratamiento si es necesario. La encefalopatía subaguda, caracterizada por déficit neurológicos focales más confusión, se produce tras el tratamiento con altas dosis de MTX y también es reversible en casi todos los casos. La leucoencefalopatía crónica, sin embargo, es un cuadro grave con demencia progresiva, ataxia de la marcha, hemiparesia, crisis y coma, aunque a veces puede existir una forma más leve. Aparece tras meses o años después de la administración del MTX (dosis altas o estándar). La RM cerebral muestra alteraciones de señal en sustancia blanca que, en ocasiones, pueden preceder al cuadro neurológico. El tratamiento previo con radioterapia craneal es el principal factor de riesgo.
- Citarabina.
La citarabina (arabinósido de citosina, Ara-C) es un análogo de pirimidina que produce la terminación de la replicación de ADN, inhibiendo así la replicación celular. Se emplea para el tratamiento de leucemias, linfomas y metástasis leptomeníngeas. A dosis convencionales no suele causar neurotoxicidad, pero a altas dosis produce un síndrome cerebeloso agudo caracterizado por disartria, nistagmo y ataxia, hasta en un 25% de los pacientes. La insuficiencia renal y la edad avanzada son los factores de riesgo para desarrollar esta complicación, por lo que una reducción de las dosis del fármaco pacientes podría prevenirla en estos pacientes. El síndrome cerebeloso suele ser reversible tras el cese de medicación y recuperarse en pocas semanas, aunque la recuperación completa sólo se da en un 30% de los pacientes. En RM cerebral se pueden objetivar datos de leucoencefalopatía y lesiones en cerebelo.
La citarabina a altas dosis puede producir dolor ocular y alteraciones de la visión secundarias a toxicidad en la córnea.
La administración intratecal de citarabina puede ser causa de mielopatía o encefalopatía. Estos efectos dependen de la dosis y de la frecuencia de administración del fármaco. La formulación de liberación lenta (citarabina liposomal, DepoCyte®) produce meningitis aséptica de mayor duración en casi todos los pacientes. Esta complicación puede prevenirse mediante la administración concomitante de corticoides.
- 5-Fluoruracilo.
Análogo de la pirimidina que interfiere en la síntesis del ADN inhibiendo la enzima timidilato sintetasa.
El 5-fluorouracilo (5-FU) no suele causar neurotoxicidad a dosis habituales. Administrado a dosis altas puede ocasionar un síndrome cerebeloso agudo similar al descrito con la citarabina, generalmente reversible tras la suspensión del fármaco.
La dihidropirimidina deshidrogenasa es la enzima limitante de la degradación del 5-FU en la ruta catabólica de las pirimidinas. La disminución de la actividad de esta enzima produce un descenso del catabolismo del fármaco con el consiguiente aumento de su toxicidad.
- Capecitabina.
La capecitabina (Xeloda®) es un análogo oral del 5-fluoracilo y presenta un perfil de efectos adversos similar. Al igual que en el caso del fármaco anterior, los efectos adversos sobre el SNC no son frecuentes cuando se administra a dosis usuales. Está descrita la encefalopatía con o sin afectación cerebelosa. La RM cerebral puede mostrar en este caso lesiones reversibles en sustancia blanca.
- Análogos de las purinas.
Los análogos de la adenosina (fludarabina y cladribina) son fármacos que producen efectos adversos en el sistema nervioso secundarios principalmente a infecciones o complicaciones metabólicas debidas a inmunosupresión y lisis tumoral. La cladribina administrada a dosis altas puede producir ceguera cortical. La fludarabina es un análogo de la purina utilizado en el tratamiento de la leucémica linfática crónica refractaria. Administrada a altas dosis puede producir neurotoxicidad importante tras 1-2 meses del tratamiento (encefalopatía, crisis, ceguera cortical e incluso estado de coma). En el tratamiento actual con fludarabina se usan dosis menores del fármaco y los pacientes tratados pueden presentar signos neurológicos reversibles como somnolencia, hemiparesia, visión borrosa y trastorno de la marcha. La relación entre la fludarabina y la leucoencefalopatía multifocal progresiva no está clara puesto que la leucemia linfática crónica también aumenta el riesgo de padecer esta complicación.
Los análogos de la guanina (6-mercaptopurina, 6- tioguanina y azatioprina) no presentan neurotoxicidad.
- Hidroxiurea.
Bloquea la síntesis de ADN inhibiendo la enzima ribonucleótido reductasa. La neurotoxicidad es rara y consiste en cefalea, confusión y sensación de mareo.
ALCALOIDES VEGETALES.
- Alcaloides de la Vinca.
Los alcaloides de la Vinca bloquean la división celular interfiriendo con los microtúbulos (estructuras celulares esenciales en el proceso de la mitosis). La vincristina y la vinblastina son dos compuestos naturales. Existen también varios compuestos semisintéticos, entre los que se encuentran la vindesina y la vinorelbina. La vincristina se usa especialmente en el tratamiento de la enfermedad de Hodgkin, los linfomas no Hodgkin y leucemia. La principal neurotoxicidad de los alcaloides de la Vinca es la afectación del SNP [Link a 3.1.2.2.2.6.2. Alcaloides de la Vinca]. Entre los efectos adversos que puede tener la vincristina sobre el SNC se encuentran neuropatías craneales, principalmente paresia del III nervio craneal, y disfunción autonómica (caracterizada por presentarse como estreñimiento y pseudoobstrucción intestinal, siendo rara la existencia de hipotensión ortostática). Los demás compuestos presentan menor neurotoxicidad.
- Etopósido.
El etopósido (VP-16) es una podofilina semisintética derivada de una planta (Podophyllum notatum) y se utiliza en el tratamiento del carcinoma pulmonar de células pequeñas, leucemia mielocítica aguda, linfomas no Hodgkin y micosis fungoide. Su administración a altas dosis puede causar cefalea, crisis y alteración del nivel de conciencia en pacientes que han sido tratados mediante trasplante de progenitores hematopoyéticos.
- Taxanos.
Los taxanos se unen a la tubulina y dañan la célula tumoral mediante un mecanismo que aún no es del todo conocido. Pertenecen a este grupo el paclitaxel y el docetaxel. Son utilizados, entre otros, en el tratamiento del cáncer de mama. Su principal neurotoxicidad es la afectación del SNP [Link a 3.1.2.2.2.6.3. Taxanos]. Entre sus efectos nocivos sobre el sistema nervioso central se encuentran encefalopatía, crisis, infarto isquémico, signo de Lhermitte y disfunción autonómica.
- L-Asparaginasa.
Esta enzima que activa la hidrólisis de la asparagina, aminoácido utilizado por las células tumorales, puede producir encefalopatía hepática y trombosis venosa, sobre todo cuando forma parte del tratamiento de inducción de la leucemia linfocítica.
- Irinotecan o CPT-11.
El Irinotecan (Camptosar®) es un inhibidor de la topoisomerasa 1 útil en el tratamiento del cáncer de colon. En algunos pacientes produce síntomas neurológicos autolimitados (disartria y ataxia) durante la infusión. Es un inhibidor de la acetilcolinesterasa y, por tanto, puede producir un síndrome colinérgico agudo (calambres abdominales, hipersalivación, diarrea y visión borrosa), que se trata con atropina.
- Retinoides (ácido trans-retinoico, ATRA, tretinoina).
El ácido trans-retinoico o ATRA (Vesanoid®) es un agente que induce la diferenciación celular en algunos tumores y es el tratamiento de elección de la leucemia promielocítica. La neurotoxicidad es la misma que la producida por la vitamina A. Ambos pueden producir hipertensión intracraneal idiopática, caracterizada por cefalea, presión intracraneal elevada y papiledema. Otros efectos adversos son la neuropatía del VI nervio craneal sin aumento de presión intracraneal y otras mononeuropatías.
-Procarbazina.
La procarbazina se utiliza en el tratamiento de gliomas, linfomas y cáncer de pulmón. Atraviesa fácilmente la BHE. Administrado a altas dosis puede producir un cuadro de bajo nivel de conciencia, desde somnolencia hasta estado estuporoso. En pacientes con gliomas (oligodendroglioma de bajo grado y oligoastrocitoma) se utiliza frecuentemente en combinación con lomustina y vincristina (PCV). En estos pacientes puede aparecer un cuadro de alteración de funciones superiores con alteración de la memoria, apatía, alteración de la personalidad, que no está en relación con la progresión del tumor cerebral.
TRATAMIENTOS HORMONALES
- Tamoxifeno.
El tamoxifeno inhibe la acción de los estrógenos y es útil contra el cáncer de mama. Produce retinopatía o queratopatía reversible, cefalea o empeoramiento de migraña previa y, a altas dosis, encefalopatía con ataxia. La neuritis óptica es una complicación muy rara de este fármaco.
- Antiandrógenos.
Los antiandrógenos son utilizados para tratar el cáncer de próstata. La goserelina (Zoladex®), un análogo de la hormona liberadora de gonadotropina (LHRH), al producir inicialmente un aumento de la liberación de hormonas sexuales, aumenta el riesgo de compresión medular si hay metástasis óseas vertebrales.
- Corticoides.
Los corticoides son los fármacos más utlizados en el tratamiento del cáncer. Los corticoides son útiles porque poseen varios mecanismos de acción útiles en esta terapia. Por una parte, tienen efecto citotóxico directo sobre las células malignas (este efecto es mucho más evidente en linfomas y leucemias); por otra parte tienen un efecto antiedema muy beneficioso en el tratamiento de tumores primarios o metástasis del sistema nervioso central, con la reducción parcial o total de los síntomas producidos por el efecto masa de la neoplasia; y, por último, los corticoides pueden aliviar síntomas secundarios del cáncer como, por ejemplo, falta de apetito, náuseas y dolor.
Los corticoides puede provocar síntomas neuropsiquiátricos como síndrome maniaco o depresión y, menos frecuentemente, cuadros psicóticos y delirantes. Estos cuadros son reversibles generalmente tras la disminución de la dosis o la suspensión del fármaco. La retirada brusca de corticoides también puede precipitar psicosis en pacientes predisponentes.
Los efectos secundarios sistémico del tratamiento esteroideo prolongado son la supresión del eje adrenocortical, miopatía, pérdida de masa ósea, inmunosupresión (riesgo de infecciones oportunistas), retención de sodio, síndrome de Cushing, cataratas, aumento de presión intraocular y riesgo de hemorragia gástrica por úlcera péptica.
AGENTES BIOLÓGICOS
- Anticuerpos monoclonales.
La mayoría de los anticuerpos monoclonales (ACM) pueden producir cefalea, fatiga y parestesias. No tienen una neurotoxicidad significativa. Existen 17 ACM con uso terapéutico aprobado, algunos de ellos como tratamiento antineoplásico, y unos 50 en ensayo clínico. Es importante tener en cuenta el síndrome de respuesta inflamatoria sistémica que puede aparecer tras su infusión en relación con reacción alérgica al anticuerpo. Aquellos ACM que atacan directamente a los linfocitos (inmunosupresores) pueden reactivar infecciones por virus herpes zoster o citomegalovirus. Los ACM no cruzan la BHE, por lo que no son efectivos contra tumores que mantienen esta barrera intacta.
- Bevacizumab.
Bevacizumab (Avastin®) es un anticuerpo monoclonal contra VEGF y se utiliza en el tratamiento de varias neoplasias, incluyendo tumores cerebrales. Puede ser causa de leucoencefalopatía posterior reversible (LPR).
- Rituximab.
Rituximab (Rituxan®) es un ACM quimérico dirigido contra el antígeno CD20 de las células linfoides de estirpe B. Su mecanismo de acción está basado en la disminución de la respuesta inmune humoral y también de la celular de forma indirecta (interfiriendo en la interacción entre ambas). Ha demostrado su eficacia en varias neoplasias linfoides, incluyendo linfomas no-Hodgkin indolentes (linfoma folicular) y agresivos (linfoma difuso células grandes), así como leucemia linfocítica crónica. Puede provocar la reactivación del virus herpes zoster cuando se administra junto con terapia CHOP (ciclofosfamida, doxorrubicina, vincristina y prednisona). Se ha relacionado el rituximab con la leucoencefalopatía multifocal progresiva (LMP) aunque la relación causal no está aún clara, puesto que las neoplasias linfoides y los demás fármacos a los que se suele asociar el tratamiento con rituximab también aumentan el riesgo de padecer esta grave patología. A pesar de esto, se advierte este posible efecto secundario con el uso de este fármaco.
- Otros Anticuerpos Monoclonales.
Gemtuzumab (Mylotarg®), usado en el tratamiento de la leucemia mieloide aguda, puede causar un síndrome veno-oclusivo con fallo hepático y hemorragias intracraneales secundarias.
El Cetuximab (Erbitux®) se usa en el tratamiento del cáncer colorrectal y cáncer de cabeza y cuello, y puede asociarse a hipomagnesemia.
El OTK3 es un ACM anti-CD3 que bloquea la función de las células T mediante la unión a ese receptor. Se han descrito con su uso casos de mutismo acinético, leucoencefalopatía posterior reversible, meningitis aséptica y crisis.
- Interleukinas.
Las interleukinas son citokinas con efecto antitumoral e inmunomodulador.
La interleukina-1 (IL-1) se utiliza para minimizar la toxicidad hematológica de los agentes quimioterápicos. La interleukina-2 (IL-2) se usa en el tratamiento del melanoma metastásico y del cáncer renal. La neurotoxicidad de la IL-2 es dependiente de dosis. Tras su administración pueden aparecer síntomas como somnolencia, agitación, alucinaciones o depresión, que generalmente ceden tras finalizar el tratamiento. Cuando es administrado intraventricularmente para tratar la diseminación leptomeníngea puede producir demencia crónica de perfil subcortical con traducción radiológica (leucoencefalopatía en RM). Están descritas con su uso pérdida de visión monocular y cuadrantanopsia, hemiparesia, ataxia, crisis y ceguera cortical.
El factor de necrosis tumoral tiene utilidad en el tratamiento de sarcomas y melanomas de las extremidades. Su neurotoxicidad es escasa y se restringe casi exclusivamente al sistema nervioso periférico.
- Interferones.
El interferon α puede producir neurotoxicidad aguda (menos de una semana tras su administración), subaguda (hasta un mes) o crónica (más de un mes). Los efectos adversos agudos consisten en parestesias, encefalopatía, mialgias, cefaleas y fatigabilidad. La toxicidad crónica, que puede ser irreversible, e incluye encefalopatía con demencia, parkinsonismo, paresias oculomotoras, y neuropatía óptica.
- Factores de crecimiento.
Se ha descrito la aparición de leucoencefalopatía posterior reversible con el factor estimulante de granulocitos-macrófagos (GM-CSF) y con la eritropoyetina. Una complicación rara de la eritropoyetina es la trombosis venosa secundaria a la policitemia.
INMUNOSUPRESORES
Algunos fármacos quimioterápicos son también inmunosupresores, como el metotrexate y la ciclofosfamida. Otros inmunosupresores se utilizan en la profilaxis del rechazo tras trasplante.
La ciclosporina y el tacrolimus, dos fármacos inhibidores de la calcineurina, presentan importante neurotoxicidad. La leucoencefalopatía posterior reversible y el mutismo acinético son dos entidades descritas en relación con estos fármacos. Se trata de cuadros graves, pero potencialmente reversibles con la retirada precoz del fármaco.
El temblor postural es el efecto adverso más frecuentemente asociado al tacrolimus.
El sirolimus y el temsirolimus, derivados de la rapamicina, tienen efecto antineoplásico al interferir en la proliferación de las células tumorales, y se utilizan en el tratamiento del cáncer renal. No presentan neurotoxicidad aparente, aunque se están describiendo efectos adversos metabólicos como hipofosfatemia e hiperglucemia.
Las inmunoglobulinas intravenosas pueden producir meningitis aséptica. Un efecto raro es el infarto cerebral, en probable relación con la hiperviscosidad sanguínea derivada de su uso.
AGENTES ADYUVANTES
- Bifosfonatos.
El ácido zolendrónico (Zometa®) y otros bifosfonatos tratan la hipercalcemia y reducen el riesgo de complicaciones óseas, incluyendo la compresión medular, en pacientes con metástasis óseas. No son neurotóxicos, pero pueden producir osteonecrosis mandibular e hipoestesia mentoniana secundaria a una mononeuropatía del nervio mentoniano o del nervio alveolar inferior. Esta complicación rara tiene importancia, ya que el diagnóstico diferencial incluye la existencia de metástasis óseas mandibulares.
- Amifostina.
La amifostina es un agente adyuvante antineoplásico o citoprotector que se usa para reducir los efectos secundarios no deseados de determinados quimioterápicos (por ejemplo el cisplatino) y de la radioterapia. Se administra por vía intravenosa. Puede producir somnolencia e hipotensión durante su infusión.
BIBLIOGRAFÍA
Albouy B, Gross Goupil M, Escudier B, Massard C. (2010) Renal cell carcinoma management and therapies in 2010. Bull cancer. 97: 17-28.
DeAngelis L, Posner J. (2009) Neurologic complications of cáncer. Ed. Oxford.
Lysandropoulos P, Renaud A. (2010). Demyelination as a complication of new inmunomodulatory treatments. Curr Op Neurol. 23(3):226-233.
Plotkin S, Wen P. (2003). Neurologic complications of cancer therapyNeurologic clinics of North America. 21: 279-318.
Rodriguez J, Cheng E, Maroto P, Duran I. (2010). Emergent toxicities associated with the use of mTOR inhibitors in patients with advanced renal carcinoma. Antican Drugs. 21(5):478-86.
Sierra F, De-Pablo E, Correas E, Villarejo A. (2009). Hipoestesia del mentón secundaria a osteonecrosis mandibular inducida por bifosfonatos. Rev Neurol. 49:190-192.
Sierra F, Martínez A, Moreno S, De- Pablo E, Correas E, Ruiz J. (2009) Akinetic Mutism Induced by Tacrolimus. Clin Neuropharmacology. 2009;32: 293-294).
Sul J, DeAngelis L. (2006). Neurologic Complications of Cancer Chemotherapy. Seminars in Oncology 33. 324-332.
Verstappen C, Heimans J, Hoekman H, Postma T. (2003). Neurotoxic Complications of Chemotherapy in Patients with Cancer. Clinical signs and optimal management. Drugs. 63(15): 1549- 1563.