Complicaciones Neurológicas del Trasplante de Células Madre Hematopoyéticas
RESUMEN
El trasplante de células madre hematopoyéticas (TCMH) consiste en la transferencia de médula ósea, células madre de sangre periférica o de cordón umbilical de un individuo a otro (TCMH alogénico) o al mismo individuo (TCMH autólogo). La complicación más importante del TCMH es la enfermedad injerto contra huésped (EICH) aguda y crónica en pacientes sometidos a trasplante alogénico. Aunque por sí misma la EICH se asocia raramente a complicaciones neurológicas, su prevención y tratamiento requiere el uso de fármacos que con frecuencia favorecen complicaciones tóxicas o infecciosas en el sistema nervioso. Por otro lado, el régimen preparatorio o acondicionamiento previo al trasplante se asocia con frecuencia a complicaciones tóxicas o metabólicas.
Las complicaciones neurológicas asociadas al TCMH son muy frecuentes y se asocian a alta morbimortalidad. Su diagnóstico es en general complejo, debido a la frecuente aparición de manifestaciones atípicas y a la coexistencia de múltiples factores que pueden explicar la disfunción neurológica. El TCMH alogénico se asocia con más frecuencia a complicaciones neurológicas que el autólogo. Los factores de riesgo más importantes para el desarrollo de complicaciones neurológicas son la existencia de EICH y la inmunosupresión crónica. Las complicaciones más frecuentes son las encefalopatías toxico-metabólicas, las complicaciones cerebrovasculares y las infecciones oportunistas del SNC.
El correcto diagnóstico de las complicaciones neurológicas en pacientes sometidos a TCMH requiere como primer paso una anamnesis detallada y revisión pormenorizada de los tratamientos recibidos por el paciente. En la mayoría de los casos será necesario el empleo de pruebas complementarias para realizar el diagnóstico diferencial. Las pruebas con mayor rendimiento diagnóstico son los estudios analíticos (que deben ser lo más completos posible para la detección de posibles complicaciones metabólicas), las pruebas de imagen (fundamentalmente la RM craneal), el EEG, la punción lumbar y, en casos en los que se sospeche afectación del sistema nervioso periférico, la electromiografía.
INTRODUCCIÓN Y DIAGNÓSTICO
El trasplante de células madre hematopoyéticas (TCMH) consiste en la transferencia de médula ósea, células madre de sangre periférica o de cordón umbilical de un individuo a otro (TCMH alogénico) o al mismo individuo (TCMH autólogo; sólo posible con los dos primeros tipos de células madre).
El paciente sometido a TCMH es manejado por hematólogos u oncólogos, lo cual requiere que el neurólogo esté familiarizado con los procesos diagnósticos y terapéuticos de estas especialidades para establecer una correlación etiológica racional de los síntomas neurológicos del paciente. La diferenciación entre un síntoma producido por la evolución de la enfermedad de base y uno que se produce como complicación del TCMH o los tratamientos usados para evitar la enfermedad injerto contra huésped (EICH) constituye a menudo un problema complejo en estos pacientes.
Las complicaciones neurológicas asociadas al TCMH son muy frecuentes y se asocian a alta morbimortalidad. La frecuencia de complicaciones neurológicas clínicamente significativas en estos pacientes puede variar entre un 10 y 40%. Los pacientes que han recibido un trasplante alogénico no emparentado tienen más riesgo de complicaciones que aquellos tratados con transplante autólogo (23,3% versus 12,2%) (Denier et al.; 2006), apuntando probablemente a la importancia de factores inmunológicos en la patogenia de este tipo de complicaciones.
Algunos factores de riesgo para el desarrollo de complicaciones neurológicas en el TCMH incluyen la leucemia mieloide aguda (LMA) como enfermedad de base, la utilización de radioterapia corporal total en el período de acondicionamiento, el empleo de metotrexate intratecal en la fase pretrasplante, la inmunosupresión prolongada y el desarrollo de enfermedad de injerto contra huésped EICH (Uckan et al.; 2005).
El diagnóstico de las complicaciones neurológicas en el paciente sometido a TCMH es en general difícil, debido a la frecuente aparición de manifestaciones atípicas y a la coexistencia de múltiples factores que pueden explicar la disfunción neurológica.
Durante la primera fase (extracción de células madre), pueden producirse complicaciones principalmente por mecanismos lesionales locales relacionados con el procedimiento. Posteriormente, la fase de acondicionamiento conlleva el uso de múltiples fármacos inmunosupresores con importantes efectos secundarios potenciales sobre el sistema nervioso. En la fase de pancitopenia previa a la reconstitución medular predominan las complicaciones infecciosas, y después de reconstituida comienzan a manifestarse complicaciones de origen inmunológico. Finalmente, en la fase de inmunosupresión crónica vuelven a predominar las complicaciones infecciosas.
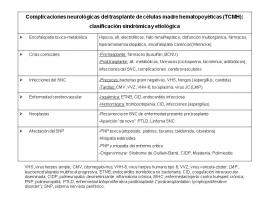
Las complicaciones neurológicas más frecuentes del TCMH son las encefalopatías toxico-metabólicas, las complicaciones cerebrovasculares y las infecciones oportunistas del SNC [Complicaciones neurológicas del trasplante de células madres hematopoyéticas (TCMH): clasificación sindrómica y etiológica.jpg].
El correcto diagnóstico de las complicaciones neurológicas en pacientes sometidos a TCMH requiere como primer paso una anamnesis detallada y revisión pormenorizada de los tratamientos recibidos por el paciente. En todo momento es importante contar con la ayuda de familiares y cuidadores que son los más sensibilizados para describir síntomas fluctuantes como alteraciones del nivel de conciencia o nuevas alteraciones respecto a la situación basal del paciente. En la mayoría de los casos será necesario el empleo de pruebas complementarias para realizar un correcto diagnóstico diferencial. Las pruebas con mayor rendimiento diagnóstico en estos pacientes son los estudios analíticos (que deben ser lo más completos posible para la detección de posibles complicaciones metabólicas), las pruebas de imagen (fundamentalmente la RM craneal), el EEG, la punción lumbar y, en casos en los que se sospeche afectación del sistema nervioso periférico, la electromiografía.
SÍNDROME DE DISFUNCIÓN MULTIORGÁNICA
El síndrome de disfunción multiorgánica (SDMO) se desarrolla habitualmente entre la infusión del injerto y la reconstitución inmune (mínimo 2 semanas) (Martínez-Hernández et al.; 2008), precedido de un síndrome de respuesta inflamatoria sistémica (hipo o hipertermia, taquicardia, taquipnea, aumento o disminución del recuento granulocítico). El endotelio vascular puede resultar dañado por citoquinas inflamatorias, lo cual lleva a un estado procoagulante con trombosis en varios órganos. Se cree que en el mecanismo patogénico de este síndrome participa la reducción de niveles séricos de anticoagulantes como la antitrombina III y la proteína C.
El SDMO suele afectar a los pulmones, hígado o SNC. Se caracteriza por la presencia de dos o más de los siguientes signos clínicos: hipoxia, hiperbilirrubinemia, aumento de peso o alteración del estado mental. Los pacientes que debutan con alteraciones del SNC tienen peor pronóstico.
La medición de los niveles de IL6 (está elevada precozmente en los pacientes con riesgo de SDMO) o el uso precoz de anticoagulantes o terapia anticitoquinas puede mejorar el pronóstico de estos pacientes (Hendrikus et al.; 2003).
HIPERAMONIEMIA IDIOPÁTICA
Es una complicación rara pero casi siempre fatal caracterizada por una encefalopatía rápidamente progresiva. Su incidencia global es del 0,5 al 1,2% (Hendrikus et al.; 2003). Generalmente se detectan niveles elevados de amonio (70 micromol/l) con perfil hepático normal, sin evidencia de alteración en el ciclo de la urea.
La fisiopatología de la elevación de los niveles de amonio en este cuadro se considera multifactorial. El incremento del metabolismo (quimioterapia, sepsis o corticoides) combinado con una sobrecarga exógena de amonio (alimentación enteral, IV o hemorragia) sobrecarga los mecanismos de depuración de esta sustancia. El tratamiento consiste en evitar la elevación de los niveles de amonio suspendiendo la carga exógena y facilitando su eliminación.
ENCEFALOPATÍA DE WERNICKE
Se trata de una causa infrecuente de encefalopatía en los pacientes con TCMH, aunque la sospecha clínica es fundamental por tratarse de un cuadro potencialmente reversible con el tratamiento adecuado. La triada sintomática clásica incluye ataxia, oftalmoplejia y alteración del nivel de conciencia.
En pacientes sometidos a TCMH su causa es habitualmente una carencia de vitamina B1 (tiamina) por vómitos frecuentes, o por la falta de suplementación en las preparaciones nutricionales IV.
La RM con difusión es una herramienta diagnóstica bastante específica (93%) para la detección precoz de la encefalopatía de Wernicke. En la encefalopatía de Wernicke clásica se observa un aumento de la señal en T2, de forma bilateral y simétrica, en la región periventricular del tálamo, cuerpos mamilares, piso del cuarto ventrículo, y área periacueductal. Estas lesiones pueden mostrar hiperintensidad de señal en difusión; sin embargo se normalizan en aproximadamente 2 semanas después del inicio de la suplementación vitamínica (Chu et al.; 2002). En ocasiones se observan lesiones en zonas atípicas, como la corteza y el cuerpo calloso (Zuccoli et al.; 2009). Al contrario de los casos de encefalopatía de Wernicke clásicos, los pacientes con encefalopatía de Wernicke asociada a TCMH no tienen afectación de los cuerpos mamilares. Se cree que la rápida progresión del cuadro hace que no aparezcan estas alteraciones en las pruebas de imagen.
El tratamiento de este cuadro se basa en la suplementación de vitamina B1. Ante un cuadro de encefalopatía de causa incierta en paciente sometido a TCMH puede ser recomendable su administración empírica.
COMPLICACIONES INFECCIOSAS
COMPLICACIONES CEREBROVASCULARES
La incidencia de complicaciones cerebrovasculares en pacientes sometidos a TCMH es incierta, siendo más frecuentes las complicaciones hemorrágicas (Hendrikus et al.; 2003).
Se han documentado casos de hematomas subdurales en pacientes con leucemia tratados con TCMH. Las coagulopatías, trombocitopenia y punciones lumbares para quimioterapia intratecal son factores de riesgo para esta complicación.
En el caso de los hematomas intraparenquimatosos las posibles causas son más complejas, e incluyen entidades como la trombosis de senos y la toxicidad por ciclosporina. La mortalidad de estos cuadros es alta.
En el caso de complicaciones isquémicas, dos tercios de las encontradas en un estudio de Johns Hopkins se debieron a complicaciones de endocarditis infecciosa. Otras causas son el daño endotelial por radiación, el uso de agentes alquilantes y el uso concomitante de ciclosporina y metilprednisolona para la profilaxis de la enfermedad de injerto contra huésped.
La EICH crónica ocurre en el 40 al 75% de los pacientes con TCH alogénico y está mediada por las células T del donante que se dirigen contra antígenos del receptor (Martínez-Hernández et al.; 2008). Aunque por sí misma la EICH se asocia raramente a complicaciones neurológicas, su prevención y tratamiento requiere el uso de fármacos que con frecuencia favorecen complicaciones tóxicas o infecciosas en el sistema nervioso. Las complicaciones neurológicas de la EICH pueden afectar tanto al sistema nervioso central como al sistema nervioso periférico.
Complicaciones neurológicas de la EICH sobre el Sistema Nervioso Central.
Las complicaciones más comunes son la encefalopatía, con o sin crisis comiciales, y los síndromes neurológicos focales.
El diagnóstico de los cuadros de encefalopatía debe abarcar las siguientes posibilidades etiológicas:
- Tóxico/metabólicas (síndrome de disfunción orgánica múltiple, alteraciones ácido base y electrolíticas, encefalopatía de Wernicke, hiperamoniemia idiopática).
- Infecciosas (virales, fúngicas, parasitarias, bacterianas).
En caso de existir déficit neurológico focal se deben considerar además:
- Síndromes vasculares cerebrales (hematoma subdural, hemorragia subaracnoidea, hematoma intraparenquimatoso).
- Angeítis del SNC (infiltrados inflamatorios perivasculares donde hay un predominio de los linfocitos T del donante) (Kamble et al.; 2007).
Se han visto también mielopatías autoinmunes similares a aquellas observadas en los pacientes con Esclerosis Múltiple.
Complicaciones neurológicas de la EICH sobre el Sistema Nervioso Periférico.
Las complicaciones de la EICH crónica incluyen varias alteraciones del SNP de carácter autoinmune como son la polimiositis, miastenia gravis y polineuropatía inflamatoria.
La fisiopatología de los casos de polimiositis no es bien conocida, pero se cree debida a una reacción de los linfocitos del donante contra los tejidos del receptor. Su sintomatología es similar a la de la polimiositis idiopática con elevación sérica de CPK. Es de vital importancia diferenciar este cuadro de aquellos de miopatía esteroidea, también comunes en este grupo de pacientes, ya que el manejo es radicalmente diferente. El estudio electromiográfico y la biopsia muscular son útiles para el diagnóstico (Hendrikus et al.; 2003).
En el caso de la miastenia gravis pueden encontrarse niveles elevados de anticuerpos anti receptor de acetilcolina en el suero de los pacientes. Se cree que estos anticuerpos son producidos por el sistema inmune del propio paciente, ya que no se encuentran cuando se estudia la sangre de los donantes. Otro argumento a favor de esta teoría es que en algunos casos el síndrome miasténico se ha manifestado hasta 5 años después del trasplante, lo cual obviamente sobrepasa la vida media de los anticuerpos del donante (Adams et al.; 1995).
En cuanto a las neuropatías, se cree que están desencadenadas por el desequilibrio inmunológico producido por el TCMH. Pueden verse alteraciones agudas como el síndrome de Guillain Barré o crónicas como la neuropatía inflamatoria desmielinizante crónica.
ENFERMEDAD LINFOPROLIFERATIVA POST TRASPLANTE (PTLD)
Esta entidad abarca un espectro de enfermedades que van desde la hiperplasia linfoide policlonal benigna hasta los linfomas monoclonales malignos.
La PTLD suele producir afectación extranodal (abdomen y tórax) y afecta al SNC en un 10% de casos (Martínez-Hernández et al.; 2008). Aparece habitualmente en el primer año post trasplante. Generalmente está producida por células B y se relaciona con la infección por el virus de Epstein Barr (VEB).
El principal factor de riesgo es la depleción de células T, pero hay otros factores importantes como la edad (menores de 10 y mayores de 60 años). Cuando se produce la expansión maligna de un clon de células B infectadas por VEB, se rompe el equilibrio donde tanto las células B como las T están deplecionadas, y aumenta el riesgo de presentación de esta complicación.
El cuadro clínico en SNC es similar al del linfoma primario, predominando la alteración del nivel de conciencia con afectación de las regiones periventriculares. El manejo de estos casos consiste en disminución de la inmunosupresión y el uso de quimioterapia (Hendrikus et al.; 2003).
Adams, C., August, C. S., Maguire, H., & Sladky, J. T. (1995). Neuromuscular complications of bone marrow transplantation. Pediatr.Neurol.12: 58-61.
Chu, K., Kang, D. W., Kim, H. J., Lee, Y. S., & Park, S. H. (2002). Diffusion-weighted imaging abnormalities in wernicke encephalopathy: reversible cytotoxic edema?. Arch.Neurol. 59:123-127.
Kamble, R. T., Chang, C. C., Sanchez, S., & Carrum, G. (2007). Central nervous system graft-versus-host disease: report of two cases and literature review. Bone Marrow Transplant. 39: 49-52.
- 27789 lecturas