Complicaciones de la Quimioterapia sobre el Sistema Nervioso Periférico
RESUMEN
La neuropatía inducida por quimioterapia (NIQ) es una complicación frecuente del tratamiento del cáncer que afecta de manera significativa a la calidad de vida de los pacientes y constituye un factor limitante de dosis que interfiere con el correcto tratamiento del cáncer.
Los agentes quimioterápicos que se asocian típicamente a NIQ son los derivados del platino, los taxanos y los alcaloides de la vinca, aunque existen muchos otros que también pueden provocarla.
La mayor parte de las NIQ son de tipo axonal. El efecto tóxico sobre el sistema nervioso periférico puede ocurrir sobre el soma neuronal o sobre el axón. El mecanismo tradicional de lesión es la degeneración axonal retrógrada, común a otras neuropatías metabólicas, tóxicas y hereditarias. Cuando la lesión ocurre estrictamente sobre el soma de la neurona sensitiva se habla de neuronopatía o ganglionopatía. La NIQ puede ocurrir preferentemente sobre las fibras motoras, sensitivas o autonómicas o ser mixta. Algunas NIQ afectan predominantemente a las fibras más finas, no mielinizadas y producen un cuadro denominado polineuropatía (PNP) de fibra fina. Las manifestaciones clínicas dependen de cuál es el tipo de fibras más afectado. El fenómeno de coasting o fenómeno de arrastre consiste en la aparición de nuevos síntomas o su progresión tras la suspensión de la quimioterapia causante de toxicidad, y es típico de fármacos como los derivados del platino.
El diagnóstico de la NIQ es fundamentalmente clínico, pero algunas pruebas complementarias pueden ser útiles en casos seleccionados (estudios de conducción convencional o electroneurografía, técnicas de valoración sensitiva cuantitativa, y otras en desarrollo).
INTRODUCCIÓN
La neuropatía inducida por quimioterapia (NIQ) es una complicación frecuente del tratamiento del cáncer y su incidencia está en aumento (Walker et al; 2007). Afecta de manera significativa a la calidad de vida de los pacientes (Cavaletti et al; 1994, Mileshkin et al; 2002) y es un factor limitante de dosis que interfiere con el correcto tratamiento del cáncer (Wolf et al; 2008, Mileshkin et al; 2006). Su diagnóstico es fundamentalmente clínico, pero algunas pruebas complementarias pueden ser útiles si el diagnóstico es complicado. No existe por el momento un tratamiento preventivo estandarizado, a pesar de la gran cantidad de investigación realizada en los últimos años. Existen estrategias prometedoras que podrían ayudar a reducir la neuropatía (Gutiérrez-Gutiérrez et al; 2010).
El efecto tóxico sobre el SNP puede ocurrir sobre el soma neuronal o sobre el axón. El mecanismo tradicional de lesión es el denominado degeneración axonal retrógrada, común a otras neuropatías metabólicas, tóxicas y hereditarias, en la que se supone que se altera tanto la producción proteica en el soma de la neurona como el transporte axonal anterógrado y retrógrado (Herskovitz et al; 2010a).
Cuando la lesión ocurre estrictamente sobre el soma de la neurona sensitiva se habla de neuronopatía o ganglionopatía, como ocurre por el cisplatino. También puede ocurrir preferentemente sobre las fibras motoras, sensitivas o autonómicas o ser mixta. Algunas NIQ afectan predominantemente a las fibras más finas, no mielinizadas y producen un cuadro denominado polineuropatía (PNP) de fibra fina, con particularidades clínicas y diagnósticas. Las manifestaciones clínicas dependen de cuál es el tipo de fibras más afectado.
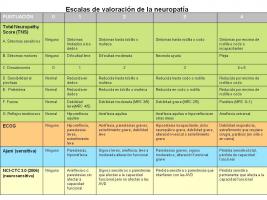
El diagnóstico de la NIQ se puede establecer clínicamente (Gutiérrez-Gutiérrez et al; 2010). Se utilizan una serie de escalas de gravedad de la NIQ [Escalas de valoración de la neuropatía.jpg]. La forma más rápida, barata y eficaz de diagnosticar una NIQ que se está desarrollando es la exploración clínica, en especial la valoración de los reflejos y de la sensibilidad vibratoria, los primeros signos en aparecer. La exploración motora debería incluir la valoración de la fuerza del extensor hallucis longus, un músculo en el que se aprecia precozmente la pérdida de fuerza (Hughes; 2008).
PRUEBAS COMPLEMENTARIAS
-Estudios electrofisiológicos:
Los estudios de conducción convencional o electroneurografía (ENG) son las pruebas más reproducibles y están disponibles en casi cualquier hospital. Sin embargo, el ENG sólo es capaz de estudiar las fibras mielinizadas rápidas más gruesas (Romero et al; 2007). El ENG es esencial para el diagnóstico de las neuropatías focales o las plexopatías. También se ha utilizado para identificar a pacientes en riesgo de sufrir NIQ antes de someterse a quimioterapia.
El ENG no es ni suficientemente sensible (Postma et al; 2000) ni específico, pues no diagnostica las NIQ más incipientes o las que afectan a las fibras más finas. Además las alteraciones en el ENG suelen aparecer cuando la NIQ ya está establecida.
Probablemente el ENG no es necesario para diagnosticar la NIQ (Mileshkin et al; 2006) excepto en situaciones en las que manifestaciones clínicas sean atípicas.
Las técnicas de valoración sensitiva cuantitativa permiten estudiar el funcionamiento de aquellas fibras no valoradas por el ENG, como las fibras finas o las autonómicas. Los estudios dependen en gran medida de la metodología y de la colaboración del paciente. Desgraciadamente no están disponibles en todos los hospitales (American Association of Electrodiagnostic Medicine; 2004).
Las técnicas de excitabilidad axonal (Park et al; 2009a, Park et al; 2009b), están aún en desarrollo y permiten estudiar la excitabilidad de los axones motores y sensitivos. Se han utilizado para el estudio de la neuropatía por oxaliplatino. Podrían identificar a pacientes con mayor riesgo de desarrollar neuropatía por cisplatino irreversible.
-Biopsia de piel: (Lauria et al; 2007a, Lauria et al; 2007b, Sommer; 2008, England et al; 2009, Erasmus Medical Center, 2010)
En los últimos años se ha desarrollado esta técnica que permite visualizar y cuantificar in vivo las fibras nerviosas de la epidermis. La biopsia de piel está siendo utilizada en algunos estudios de neuroprotección como el patrón oro. Existe un ensayo clínico en marcha para valorar el valor de la biopsia de piel en la NIQ (Erasmus Medical Center; 2010).
TRATAMIENTO
No existe de momento un tratamiento eficaz demostrado para la NIQ. Existen indicios de que algunos suplementos nutricionales, como la L-carnitina, podrían producir mejoría en algunos pacientes.
-Educación: La educación del paciente con NIQ establecida es esencial para mejorar su calidad de vida. Debe darse información adecuada sobre la necesidad de vigilar la temperatura de alimentos y objetos, el uso de guantes y calcetines, la importancia de una adecuada iluminación de la vivienda, el uso de bastones u ortesis, bañeras antideslizantes, barras, dispensadores de jabón, maquinillas y cepillos de dientes eléctricos.
-Rehabilitación: La rehabilitación permite a muchos pacientes mejorar su calidad de vida, especialmente aquellos con trastornos propioceptivos.
-Sintomático del dolor neuropático. [Link a B.10. Tratamiento del Dolor Neuropático]
La neuroprotección es todavía un campo en investigación. Sin embargo se han hecho importantes avances en los últimos años.
La neuroprotección debe diferenciarse del tratamiento de la neuropatía establecida, aunque algunos agentes parece que podrían tener propiedades tanto neuroprotectoras como neurorregenerativas.
Cualquier tratamiento neuroprotector debe prevenir la neuropatía sin alterar la eficacia del tratamiento sobre el cáncer.
La prevención de la NIQ debería comenzar con la identificación de aquellos pacientes con mayor riesgo de padecer neuropatía. Los pacientes que hayan sufrido daño previo en el sistema nervioso periférico o con enfermedades que dañan el sistema nervioso periférico o alteran su regeneración, como la diabetes mellitus, el hipotiroidismo, o el alcoholismo, deberían ser vigilados de cerca. Los pacientes con DM deberían tener sus niveles de glucemia estrictamente controlados, sobre todo si se utilizan corticoides.
Debería asegurarse un estado nutricional adecuado. Algunas vitaminas y nutrientes son especialmente importantes en el mantenimiento trófico del sistema nervioso, como la B1, B6, B9, B12, el ácido fólico, la vitamina E o el cobre. Algunos de estos nutrientes se están investigando como posibles neuroprotectores. Los pacientes malnutridos, alcohólicos o con cirugía gastrointestinal previa que implique malabsorción también tienen un riesgo aumentado de desarrollar NIQ.
Todos los pacientes deberían tener una exploración neurológica basal. Posiblemente algunos deberían tener también un ENG (Gutiérrez-Gutiérrez et al; 2010).
La farmacogenética podría permitir en un futuro seleccionar a los pacientes con diferentes sensibilidades a la quimioterapia. Ruzzo han descrito un genotipo que predispone a sufrir neuropatía por oxaliplatino (Ruzzo et al; 2007).
Estrategias neuroprotectoras:
1. Cambios en la administración: Reducir la dosis del fármaco quimioterapéutico, disminuir la velocidad de infusión o aumentar el tiempo entre dosis. Algunas veces la única forma de evitar mayor daño es interrumpir el tratamiento definitivamente.
Los agentes quimioterápicos que se asocian típicamente a NIQ se resumen en la siguiente tabla [Quimioterápicos que pueden producir neuropatía.jpg]. A continuación se resumen los más significativos.
Los compuestos derivados del platino se han usado en el tratamiento del cáncer durante más de 40 años. El mecanismo de acción de los platinos parece ser similar a los agentes alquilantes que se unen al ADN (Ta et al; 2009). Esta unión produce apoptosis de las neuronas (Gill et al; 1998). Todos los platinos producen una afectación sensitiva pura mediante la lesión de la neurona en el ganglio raquídeo. Es por tanto una ganglionopatía o una neuronopatía. Esto podría explicarse en parte por la vascularización a través de capilares fenestrados de los ganglios raquídeos (McKeage et al; 2001). La neurotoxicidad es un factor limitante de dosis de todos los platinos. En todos ellos puede aparecer el fenómeno de arrastre o coasting.
1. CISPLATINO: fue inicialmente descrita en 1980 (Cubillo et al; 1980). El desarrollo de neuropatía es proporcional a la dosis total (McKeage et al; 2007). Aparece neuropatía significativa en pacientes que reciben más de 400-500 mg/m2 de cisplatino, típicamente a los 3-6 meses del inicio. Es una neuropatía sensitiva que se inicia con parestesias distales. Se alteran todas las modalidades sensitivas, pero predomina la pérdida de las funciones mediadas por fibra gruesa. En casos avanzados puede existir ataxia sensitiva grave. El síntoma de Lhermitte es frecuente. Puede haber disautonomía en forma de mareo, palpitaciones o impotencia (Hansen; 2006).
2. OXALIPLATINO: la neurotoxicidad es el factor limitante de dosis más frecuente y se desarrolla en un 60-80% de los pacientes. Existe una toxicidad aguda inducida por frío que incluye parestesias reversibles en la garganta, boca cara y manos que aparecen en unos 30-60 minutos del inicio de la infusión y habitualmente durante el segundo o tercer ciclo de quimioterapia. También se presentan disestesias, en ocasiones quemantes, que aparecen al contacto con superficies o líquidos fríos. Generalmente remiten en dos o tres días tras la infusión. Sin embargo, hasta un 20-30% de los pacientes desarrollan un déficit sensitivo permanente similar al producido por el cisplatino (Krishnan et al; 2006).
3. CARBOPLATINO: es menos neurotóxico, aunque dosis altas producen el mismo tipo de neuropatía que el cisplatino, sobre todo al combinarlo con placitaxel. Con esta combinación un 20% de los pacientes desarrollan una neuropatía moderada o grave (McKeage; 1995).
Los alcaloides de la vinca producen su efecto tóxico sobre las células malignas y sobre el nervio a través de la inhibición del ensamblaje y promoviendo el desensamblaje de los microtúbulos. Afectan al transporte axonal (Pan et al; 2003). Existen cuatro fámacos: vincristina, vinblastina, vindesina (Gutiérrez-Rivas et al; 1984) y vinorelbina. Todas ellas producen una neuropatía sensitivomotora dependiente de dosis. La neurotoxicidad más grave la producen la vincristina y la vindesina, mientras que la vinorelbina y la vinblastina parecen menos tóxicas. La NIQ se presenta generalmente en los tres primeros meses de tratamiento. Los primeros síntomas son parestesias y disestesias distales con alodinia. Debilidad y calambres son frecuentes síntomas de afectación motora. También se han descrito mononeuropatías focales (femoral, peroneal) y craneales (Kalcioglu et al; 2003). Puede haber disautonomía. Se ha descrito fenómeno de arrastre (Verstappen et al; 2005). Las secuelas permanentes son frecuentes en los supervivientes (Ramchandren et al; 2009).
Los taxanos son estabilizadores de los microtúbulos. Existen tres: el paclitaxel, el docetaxel y el ABI-007 (Abraxane®). El ABI-007 es un paclitaxel en una formulación sin aceite de castor polioxietilado con mejor perfil de toxicidad que el paclitaxel con este aceite de castor. Además existe un grupo de nuevos quimioterapéuticos, las epotilonas, como la ixabepilona, BMS-310705, patupilona, epotilona D y ZK-EPO, que también actúan mediante la estabilización de los microtúbulos y que producen una neuropatía similar a la de los taxanos (Camps et al; 2005, Whitehead et al 2006). La neuropatía es un efecto secundario importante de estos agentes quimioterapéuticos. Hasta un 30% de los pacientes pueden sufrir una neuropatía de grado 3 o 4. Esta neuropatía es una axonopatía que puede asociar cierto grado de mielinopatía. El mecanismo parece ser la alteración del transporte axonal por la alteración de los microtúbulos. Es un tratamiento administrado con frecuencia junto al cisplatino, que aumenta su toxicidad. Los taxanos producen una neuropatía sensitivomotora de predominio sensitivo. La mitad de los pacientes mejoran de sus síntomas en un período de meses (Lee et al; 2006).
Existe un cuadro agudo de dolor tras la infusión de paclitaxel que algunos autores sugieren que podría tratarse de un tipo de neuropatía motora aguda. El cuadro aparece a las 24-48 horas tras la administración del placitaxel y dura una media de 4-5 días. Los pacientes describen un dolor sordo, mal definido en la espalda, hombros, caderas, muslos, piernas y pies (Wolf et al; 2008).
El bortezomib es un inhibidor reversible del proteasoma 26S, un complejo proteico implicado en la degradación de las proteínas ubiquitinadas y en la regulación de la homeostasis celular. Su inhibición produce un efecto proapoptótico en las células neoplásicas, que ha demostrado gran eficacia en el tratamiento del mieloma múltiple. Produce una neuropatía proporcional a la dosis fundamentalmente sensitiva, aunque también puede haber neuropatía motora en casos graves. La neuropatía es inicialmente de fibra fina y puede asociar dolor neuropático. La neuropatía es en general reversible con la suspensión del tratamiento (Cavaletti et al; 2007).
La talidomida se utiliza como tratamiento de diversas enfermedades y en la quimioterapia contra el mieloma múltiple. Produce una polineuropatía sensitivomotora en un 20-40% de los pacientes. Esta neuropatía aumenta con la edad y la dosis total del fármaco. Los primeros síntomas son sensitivos, aunque pueden aparecer también calambres distales (Rabasa et al; 1994, Moehler et al; 2006). La lenalidomida, un análogo de la talidomida, parece producir una neuropatía similar pero más leve (Kotla et al; 2009).
El ara C o citarabina produce en 1% de los casos una neuropatía desmielinizante aguda similar al síndrome de Guillain-Barré (Alonso-Ortiz et al; 1990, Openshaw et al; 1996).
El etopósido produce una polineuropatía sensitivomotora leve (Thant et al; 1982).
Hasta un 10% de los pacientes en tratamiento con gemcitabina puede sufrir una neuropatía leve y una minoría puede presentar síntomas más graves (Dormann et al; 1998).
El tipifarnib produce una neuropatía leve (Burnett et al; 2007).
El zactima, produce una neuropatía sensitiva leve en un 20% de los pacientes (Kovacs et al; 2006).
El prospidio, un fármaco utilizado para el tratamiento del sarcoma de Kaposi producía una neuropatía dependiente de dosis (Gutiérrez-Rivas et al; 1984).
El bevacizumab puede producir neuropatía óptica al asociarse con radiación en pacientes con glioblastoma (Sherman et al; 2009).
El sorafenib puede producir una neuropatía sensorial no acumulativa, generalmente paralela a la aparición de síndrome mano-pie (Kane et al; 2006).
- 69181 lecturas