TC craneal en patología vascular cerebral
INTRODUCCIÓN
La tomografía computerizada craneal (TC) se ha convertido en una herramienta básica en el diagnóstico inicial de la patología vascular cerebral. Es un método diagnóstico fácil, accesible y disponible actualmente en la práctica totalidad de los servicios de urgencia hospitalaria.
Desde finales del siglo XX, con la llegada de la TC multicorte, se pueden realizar cuatro modalidades diferentes de TC: TC basal, TC perfusión, angioTC cerebral y TC postcontraste.
TC BASAL
La TC basal consiste en la adquisición de imágenes axiales desde base de cráneo hasta vértex craneal. El TC basal es la herramienta inicial en la valoración en la patología vascular cerebral.
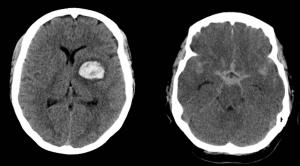
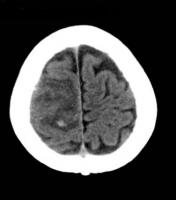
Es la técnica de elección en la detección de la hemorragia cerebral con una sensibilidad del 100% y una especificidad del 95%. Es capaz de detectar tanto la hemorragia intraparenquimatosa como la hemorragia subaracnoidea agudas (Ver Hemorragia.jpg). La hemorragia subaracnoidea subaguda se hace isodensa con el líquido cefalorraquídeo en las imágenes de TC con lo que es muy difícil su detección. En este caso, y ante una sospecha clínica elevada de hemorragia subaracnoidea, está indicado la realización de una RM cerebral (secuencias FLAIR y T2*) y/o punción lumbar.
Figura Hemorragia. Se aprecia hematoma intracerebral y hemorragia subaracnoidea.
En la patología isquémica, fundamentalmente en infartos de arteria cerebral media o infartos carotídeos, es capaz de detectar los siguientes signos precoces de isquemia (Srinivasan et al; 2006):
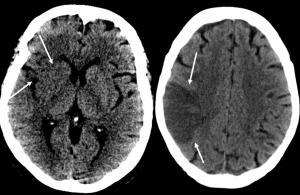
-Hipodensidad focal en los ganglios de la base y en el córtex insular; estos territorios son los más sensibles a la isquemia debido a la existencia de vascularización terminal y falta de colateralidad. [Ver Hallazgosprecoces1.jpg].
-Pérdida de la diferenciación entre sustancia gris y sustancia blanca.
-Borramiento de los surcos de la convexidad.
-Signo de la arteria cerebral media hiperdensa, por la existencia de trombo o émbolo intravascular [Ver Hallazgosprecoces2.jpg].
Figura Hallazgosprecoces
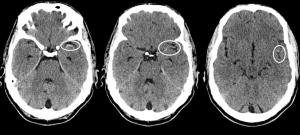
Hay que recordar que una TC sin hallazgos no excluye la existencia de isquemia [Ver TCsinhallazgos.jpg].
La TC tiene menos sensibilidad y especificidad que la RM en la detección precoz de isquemia en infartos periféricos/corticales, en infartos lacunares y en infartos de fosa posterior.
Figura TC sin hallazgos.
La TC tiene un papel fundamental en el control postfibrinolisis en pacientes con infartos cerebrales para descartar la existencia de transformación hemorrágica o progresión isquémica.
La TC también es capaz de detectar infartos de origen venoso con la existencia de una hipodensidad/edema corticosubcortical con o sin hemorragia intraparenquimatosa asociada [Ver Infartovenoso.jpg]. Así mismo puede visualizar su causa mediante la detección de un seno venoso dural más denso en el estudio basal, indicativo de trombosis. Es menor la capacidad de visualización de trombosis de venas corticales; ante su sospecha está indicado completar el estudio con la realización de una RM.
Figura Infartovenoso.
ANGIOTC CEREBRAL
La angioTC cerebral consiste en la realización de un TC multicorte tras administración de una embolada de contraste iv (80ml) con un flujo elevado (3.5-4 ml/segundo), obteniendo imágenes axiales desde cayado aórtico/base de cráneo hasta el vértex craneal. Posteriormente, en consolas de trabajo, se realizan reconstrucciones MPR (multiplanares), reconstrucciones MIP (máxima intensidad de proyección) y reconstrucciones VR (volumen rendering), que permiten una visualización óptima de las estructuras vasculares intra y extracraneales.
En el caso de existencia de hemorragia (intraparenquimatosa o subaracnoidea) permite la detección de aneurismas, habitualmente localizados en las arterias del polígono de Willis, así como de malformaciones arteriovenosas piales o durales (éstas últimas con mayor dificultad).
En el caso de existencia de isquemia permite valorar el estado de las arterias cervicales e intracraneales, su teórico punto de oclusión (única o en tándem) y descartar disección. También permite valorar el grado de circulación colateral.
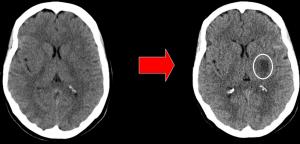
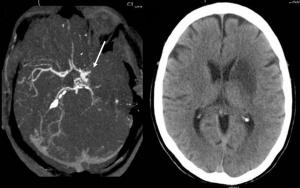
En la siguiente imagen de TC se identifica una oclusión de la arteria cerebral media proximal izquierda [Ver Oclusiónvascular.jpg].
Figura. Oclusiónvascular.
También la angioTC es capaz de detectar vasodilatación (síndrome de hiperperfusión o por reperfusión isquémica) vasoespasmo (tras hemorragia subaracnoidea o en el síndrome de vasoconstricción reversible) y signos de vasculitis ( estenosis y dilataciones, aneurismas micóticos distales a las arterias del polígono de Willis etc..).
Hoy en día también es posible la realización de un angioTC de senos venosos (Linn J et al; 2007) que permite valorar de manera adecuada el estado de los senos venosos durales y descartar su trombosis con unos valores de sensibilidad y de especificidad similares a la RM; incluso es capaz de diferenciar con mayor sensibilidad que la RM entre un seno transverso trombosado y uno hipoplásico.
TC PERFUSIÓN
La TC perfusión consiste en las adquisición continua de imágenes axiales a nivel de los ganglios de la base a lo largo de un tiempo determinado (50-70 segundos), durante la administración de una embolada intravenosa de contraste a alto flujo (5ml/segundo) y alta concentración (300-400 mg/ml) pero con baja dosis (50 ml) seguida de una embolada similar de suero fisiológico. Así se consigue la monitorización del paso de CIV a través del lecho vascular tisular cerebral, existiendo una relación lineal entre la concentración y la atenuación por contraste.
Por complejos métodos y algoritmos matemáticos (Konstas A et al; 2009) los sofware de las consolas de trabajo permiten la visualización de unos mapas de perfusión que incluyen la medición cuantitativa del flujo (CVF) y volumen (CBV) a través del lecho microvascular cerebral, así como de otros parámetros como el tiempo al pico (TTP), tiempo de tránsito medio (TTM) y permeabilidad vascular (Wintermark M et al; 2009).
Hoy en día la TC perfusión juega un papel crítico en la valoración de la isquemia cerebral aguda, al ayudar a la toma de decisiones terapéuticas que cada vez son más dependientes de la fisiología aplicada a la imagen (González; 2006).
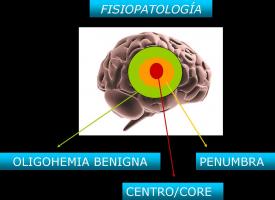
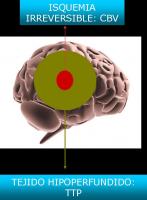
En el ictus isquémico agudo se define como core o centro el tejido cerebral que cumple los siguientes criterios ( Muir K et al; 2006):
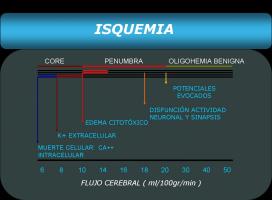
Tejido cerebral con flujo cerebral con menos de 10ml/100gr/min.
Tejido isquémico no recuperable.
Tejido con muerte celular irreversible.
Definimos como penumbra el tejido cerebral potencialmente salvable, con:
Flujo cerebral con menos de 20ml/100gr/min.
Disfunción de la actividad neuronal.
Destino incierto.
Definimos como oligohemia benigna el tejido cerebral levemente hipoperfundido con:
Flujo cerebral con menos de 50ml/100gr/min.
No existencia de riesgo de isquemia irreversible (Ver “Fisiopatologíadelaisquemia1.jpg).
Si la penumbra no recibe tratamiento existe riesgo potencial de incorporarse al core. Este hecho depende de dos factores: del tiempo transcurrido y de la severidad en la reducción del flujo vascular cerebral. (Srinivasan et al; 2006) (Ver “Fisiopatologíadelaisquemia2.jpg”).
Figura. Fisiopatologíadelaisquemia
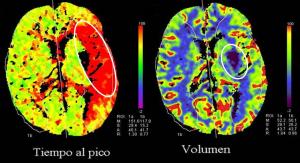
La TC perfusión es capaz de detectar el tejido cerebral hipoperfundido, que corresponde a las áreas de penumbra y oligohemia benigna periférica (mapas de tiempo al pico o de tiempo de tránsito medio) y el tejido con isquemia establecida, irreversible, el core (mapa de volumen) (Ver“Fisiopatologíadelaisquemia3.jpg”). La diferencia entre los mapas de tiempo (TTP) y el mapa de volumen (CBV) permite la valoración aproximada del tejido potencialmente recuperable (Marco E et al; 2008). En el caso de que éste sea significativo el paciente es candidato radiológico a tratamiento revascularizador. En la siguiente figura se muestra una oclusión de la arteria cerebral media izquierda con pequeño core isquémico que afecta al núcleo lenticular (azul marino en el mapa de CBV) y tejido potencialmente recuperable hipoperfundido del resto del territorio de la arteria cerebral media, con colores rojos en el mapa de TTP [Ver Perfusión.jpg].
Figura Perfusión.
Existen estudios actuales que relacionan la existencia de patlak o permeabilidad vascular en un infarto agudo (medidor indirecto de la rotura de barrera hematoencefálica) con una posible transformación hemorrágica.
Los mapas de perfusión vascular cerebral se pueden utilizar en la actualidad como detectores indirectos de la existencia de vasoespasmo con la visualización de áreas hipoperfundidas o de penumbra. También permiten valorar el síndrome de hiperperfusión (Link a 1.12. SÍNDROME DE HIPERPERFUSIÓN) en pacientes tras procedimientos diagnósticos o terapéuticos invasivos carotídeos (aumento del volumen y del flujo sanguíneo cerebral).
Respecto a la perfusión RM perfusión la CT tiene la desventaja de que sólo cubre un territorio cerebral específico ( 3-5 cm de grosor ), si bien esta limitación desaparecerá en el futuro con la llegada de TC con mayor número de detectores (Siebert E et al; 2009).
TC POSTCONTRASTE
La TC postcontraste es similar a la TC basal en cuanto a la adquisición de imágenes y se realiza tras administración de contraste intravenoso a dosis medias (70-90 ml), a bajo flujo (1.5-2 ml/sg) y con un retraso en la adquisición de imágenes de unos 180-200 sg tras la embolada de contraste.
En los pacientes con hemorragia permite visualización de malformaciones vasculares arteriovenosas, aneurismas arteriales o venosos de gran tamaño etc.
También es capaz de detectar signos de reperfusión o de colateralidad en los pacientes con isquemia así como captaciones patológicas del parénquima cerebral (realce giriforme o leptomeníngeo, en infartos subagudos, encefalitis, crisis epilépticas etc...).También permite valorar el signo del delta vacío en los pacientes con trombosis de senos venosos ( defecto de repleción por contraste de un seno venoso).
BIBLIOGRAFÍA
González R. (2006). Imaging-Guided Acute Ischemic Stroke Therapy: From “Time Is Brain” to “Physiology Is Brain”. Am J Neuroradiol. 27:728 –735.
Konstas A, Goldmakher G, Lee T, Lev M. (2009). Theoretic Basis and Technical Implementations of CT Perfusion in Acute Ischemic Stroke, Part 1:Theoretic Basis. Am J Neuroradiol. 30:662–668.
Linn J, Ertl-Wagner B, Seelos K, Strupp M, Reiser M, Bruckmann H et al. (2007). Diagnostic Value of Multidetector-Row CT Angiography in the Evaluation of Thrombosis of the Cerebral Venous Sinuses.Am. J. Neuroradiol. 28: 946 - 952.
Marco E, Sánchez E, Gutiérrez A,González A, Ruiz E, Fernández A et al. (2008). CT Protocol for Acute Stroke: Tips and Tricks for General Radiologists. RadioGraphics. 28:1673–1687.
Muir K, Buchan A, Von Kumer R, Rother J, Baron J. (2006). Imaging of acute stroke. Lancet Neurol. 5 :755-768.
Siebert E, Bohner G, Dewey M, Mahsuhr F, Hoffmann k, Mews J et al. (2009). 320-slice CT neuroimaging: initial clinical experience and image quality evaluationThe British Journal of Radiology. 16:1-10.
Srinivasan A, Goyal M, Al Azri F, Lum C. (2006).State-of-the-Art Imaging
of Acute Stroke. RadioGraphics. 26: S75–S95.
Wintermark M, Albers G, Alexandrov A, Alger J, Bammer R, Baron J et al. (2008). Acute Stroke Imaging Research Roadmap. Stroke. 39:1621-1628.
- 89779 lecturas