Tratamiento quirúrgico de las malformaciones vasculares cerebrales
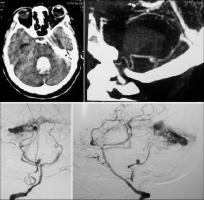
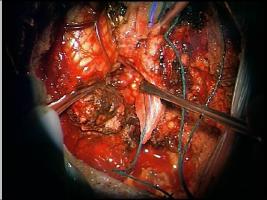
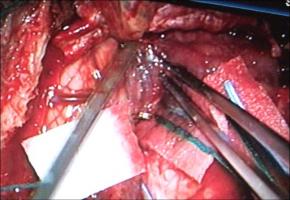
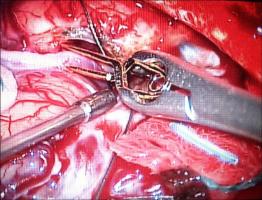
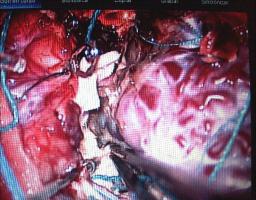
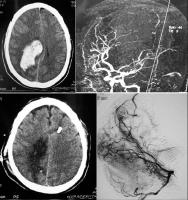
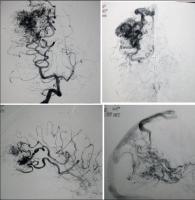
INTRODUCCION.Las malformaciones arteriovenosas (MAVs) cerebrales representan las lesiones más complejas y difíciles de tratar para el neurocirujano vascular. El objetivo del tratamiento quirúrgico consiste en lograr una resección completa de la lesión, minimizando la morbilidad y la mortalidad quirúrgicas. La consecución del mismo requiere una planificación exhaustiva, la aplicación meticulosa de la ténica microquirúrgica y un seguimiento exquisito del paciente durante el periodo postoperatorio (Riina et al; 2001).PLANIFICACION QUIRURGICA. Indicación quirúrgica.Debe basarse en un balance apropiado entre la historia natural - fundamentalmente el riesgo de hemorragia - de la MAV no tratada (o tratada mediante otras ténicas no quirúrgicas), y el riesgo previsible del tratamiento quirúrgico, teniendo en cuenta los resultados individuales del cirujano que va a realizar la intervención quirúrgica. Se asume que un paciente, considerado de forma individual, se beneficiará del tratamiento quirúrgico si éste se aplica sin producir mortalidad o secuelas neurológicas discapacitantes. En este sentido, los factores más importantes para determinar la operabilidad de una MAV son su localización, accesibilidad quirúrgica y angioarquitectura (aferencias arteriales, tamaño del nido, patrón de drenaje venoso, flujo de la lesión y fenómenos de robo del parénquima encefálico adyacente), incluídos por Spetzler y Martin en su sistema de gradación simplificado y de uso universal (Spetzler et al; 1986). Sin embargo, existen factores adicionales con implicaciones pronósticas determinantes, como el estado general y neurológico del paciente, la expresión clínica de la MAV (fundamentalmente si se trata o no de una presentación hemorrágica) y la experiencia del equipo microquirúrgico; la relevancia de dichas variables ha dado lugar a sistemas más exhaustivos de clasificación de las MAVs, que reflejan de forma más fidedigna la situación global de un paciente que va a precisar un tratamiento quirúrgico de alta complejidad (Lawton et al; 2010). Las crisis epilépticas constituyen, tras la hemorragia, la segunda forma de presentación más frecuente de las MAVs. Fundamentalmente, las crisis se asocian epidemiológicamente con lesiones de más de 3 cm de diámetro, localizadas en estrecha relación con la corteza cerebral y, especialmente, aquellas que se relacionan con el lóbulo temporal (Hoh et al; 2002). La epileptogénesis puede darse en base a varios factores: la isquemia del parénquima adyacente por fenómenos de "robo" de flujo sanguíneo, el desarrollo de un área de gliosis perilesional, y/ o la presencia de depósitos de hemosiderina en el parénquima encefálico adyacente a la MAV; sin embargo, cabe recordar que pueden desarrollarse fenómenos de epileptogénesis secundaria en focos a distancia de la lesión vascular, exaltados por la actividad de conexiones sinápticas excitatorias presentes en las inmediaciones de la MAV (Yeh et al; 1990, Hoh et al; 2002). Por lo tanto, se recomienda que la planificación quirúrgica de las MAVs cerebrales que asocian crisis epilépticas se realice bajo el enfoque diagnóstico y terapéutico de la cirugía de la epilepsia, cuya metodología ayudará a optimizar los resultados en cuanto al pronóstico de las crisis epilépticas se refiere (Scramm J et al; 2008). La tercera forma de presentación viene representada por los déficits neurológicos, que pueden responder a un efecto compresivo directo de la MAV sobre el parénquima elocuente adyacente y/ o a fenómenos de isquemia del mismo por "robo" de flujo arterial. Por otra parte, existen casos en los que la presencia de edema vasogénico puede resultar determinante; se trata de un fenómeno de baja frecuencia (1,6% de las MAVs, consideradas de forma global) que se ha relacionado con un déficit en el drenaje venoso de la lesión, y que puede dar lugar a déficits neurológicos progresivos, isquemia venosa o fenómenos de hemorragia (Kim et al; 2009). En el caso de MAVs no operables, que producen déficits neurológicos progresivos debido a la asociación de edema vasogénico, puede indicarse la realización de una embolización paliativa que, si bien no ha demostrado modificar el riesgo de hemorragia, puede lograr el control de los síntomas de focalidad neurológica, al disminuír la congestión vascular y, por lo tanto, el edema (Kim; 2009). Estudio de la MAV.El desarrollo de una estrategia quirúrgica concreta para tratar una MAV cerebral requiere un conocimiento detallado sobre la estructura y biología de estas lesiones (Moftakhar et al; 2009): no se trata de lesiones congénitas estáticas, sino de estructuras dinámicas que pueden experimentar fenómenos de crecimiento, involución y recurrencia tras una obliteración parcial o completa. Desde un punto de vista estructural, las MAVs se componen, fundamentalmente, de una o varias aferencia(s) arterial(es); un nido o conglomerado de vasos patológicos, que ponen en comunicación directa el flujo sanguíneo arterial y venoso; y, finalmente, un drenaje venoso único o múltiple [Figura 1 jpg]. De manera adicional, las MAVs pueden asociar aneurismas relacionados o no con el flujo de la lesión vascular (Fleetwood; 2002). Los aneurismas tipo I no están asociados con el flujo de la MAV y deben tratarse de forma independiente a esta. Los aneurismas dependientes del flujo arterial de las MAVs pueden localizarse en los segmentos proximales de la arteria nutricia en el polígono de Willis (tipo II), en la propia arteria nutricia (tipo III) o en el nido vascular (tipo IV); este grupo asocia un alto riesgo de producir fenómenos hemorrágicos y, por lo tanto, deben ser considerados en la estratagia terapéutica de la MAV. La TC y angio-TC de la [Figura 2 jpg] muestran una hemorragia panventricular, con hidrocefalia aguda asociada, como consecuencia del sangrado de un aneurisma de flujo tipo III dependiente de la arteria cerebelosa posteroinferior derecha. Dicha arteria nutre, junto con aferencias de la arteria cerebelosa superior, una MAV con un nido de 2,5 cm de diámetro, localizado en la convexidad y superficie tentorial del hemisferio cerebeloso derecho, como demustra la arteriografía de sustracción digital (ASD). El drenaje venoso se dirige, a través de una vena única, hacia la tórcula. El paciente fue intervenido mediante una ventriculostomía frontal derecha, seguida de una craniectomía de fosa posterior, incluyendo el arco posterior de C1, con exposición de ambos senos transversos y la tórcula. El aneurisma fue identificado en la rama medial del segmento tonsilomedular de la arteria cerebelosa posteroinferior derecha, procediéndose a su clipaje [Figura 3 jpg]. A continuación, se procedió al control de las aferencias arteriales procedentes de la arteria cerebelososa posteroinferior y la arteria cerebelosa superior [Figura 4 jpg] , la disección del nido [Figura 5 jpg] y, finalmente, la oclusión del drenaje venoso [Figura 6 jpg].
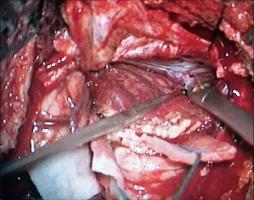
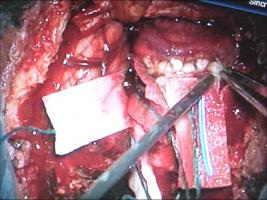
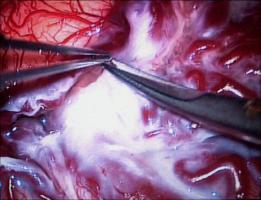
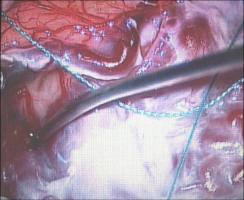
El estándar para la valoración de la angioarquitectura y características hemodinámicas de las MAVs es la ASD (Unlu et al; 2006). Esta técnica de neuroimagen debe ser completada mediante la realización de una IRM y angio-IRM con contraste, que aportan información sobre el tamaño y la morfología tridimensional del nido, sobre la presencia de áreas de sangrado y/ o edema vasogénico asociado, así como acerca de las relaciones anatómicas de la lesión con el parénquima encefálico adyacente (Leclerc et al; 2004, Riina et al; 2001). La neurorradiología moderna, en contínua evolución, ha desarrollado técnicas que permiten complementar el estudio de la estructura las MAVs con información dinámica sobre su flujo sanguíneo y presión, así como sobre la perfusión del parénquima encefálico adyacente (Bambakidis et al; 2001). La localización de la MAV en relación con un parénquima encefálico supuestamente elocuente constituye una de las principales barreras a la hora de plantear el tratamiento quirúrgico. Tradicionalmente, el concepto de elocuencia se ha asignado a determinadas regiones encefálicas de forma empírica, sobre una base estrictamente anatómica (Spetzler et al; 1986). Sin embargo, la localización anatómica de las áreas elocuentes presenta una alta variabilidad interindividual y, además, existen evidencias de la presencia de fenómenos de reorganización funcional cortical en los pacientes que presentan MAVs cerebrales (Lazar et al; 2001). Por lo tanto, se debe partir de un estudio cognitivo individualizado de cada paciente tanto durante el periodo de planificación quirúrgica - incluyendo un estudio neuropsicológico minucioso, IRM funcional, tensor de difusión-tractografía, test WADA... - como durante el mismo acto quirúrgico, realizando de forma sistemática monitorización neurofisiológica intraoperatoria y, en ocasiones, la cirugía con el paciente despierto. Recientemente, se ha descrito la aplicación de tecnología de realidad virtual para la planificación del tratamiento quirúrgico de las MAVs cerebrales. Este modelo de trabajo permite la integración de la información multimodal de neuroimagen en un único modelo tridimensional, que permite la interacción con el cirujano a través de un simulador quirúrgico de realidad virtual (Ng at al; 2009). En el caso de MAVs complejas, de gran tamaño o profundas, se recomienda disponer del equipamiento y personal necesario para realizar una angiografía intraoperatoria (AIO). Se trata de la técnica de referencia para evaluar el estado hemodinámico de la lesión en tiempo real, visualizar aferencias arteriales no detectadas en la arteriografía preoperatoria, y valorar la presencia de nido residual; en consecuencia, esta información resultará esencial a la hora de afrontar un sangrado intraoperatorio incontrolable e inexplicado (Hasimoto et al; 2007). La angiografía de fluorescencia con indocianina también ha demostrado su utilidad para identificar los vasos malformativos, distinguir las arterias de las venas arterializadas y demostrar la presencia de nido residual (Killory et al; 2009). Se trata de una técnica rápida, no invasiva, de mínima morbilidad para el paciente y bajo coste, que integra la información en el mismo microscopio y no precisa personal adicional especializado en el quirófano. Sin embargo, presenta serias carencias a la hora de evaluar lesiones profundas y debe considerarse, por lo tanto, un complemento, más que un sustituto, de la AIO. Finalmente, algunos autores abogan por la utilidad de la ecografía Doppler intraoperatoria que, en manos experimentadas, puede ayudar a diferenciar las arterias malformativas de los vasos "de paso" y a confirmar la exéresis total de la MAV (Dempsey et al; 2004). Abordaje quirúrgico.El diseño de la craneotomía, de forma general, debe contemplar una exposición amplia de la superficie de la MAV, así como la obtención de un acceso cómodo al drenaje venoso (Natarajan et al; 2008, Riina et al; 2001). En el caso de MAVs profundas, pueden aplicarse los conceptos de cirugía mínimamente invasiva o abordajes "keyhole" (Hernesniemi et al; 2010). Actualmente, tanto el diseño del abordaje como el acceso a la lesión, especialmente de aquellas MAVs de localización profunda, se ven enormemente facilitados por la utilización sistemática de los sistemas de neuronavegación que, además, permiten integrar información anatómica y funcional. Sin embargo, su principal defecto es la ausencia de actualización de información a medida que se producen cambios estructurales durante el acto quirúrgico. Una vez ejecutada la craneotomía, es fundamental realizar la apertura de la duramadre bajo visión microscópica, especialmente en MAVs superficiales, en el caso de reintervenciones, así como en aquellas que han sido embolizadas o radiadas previamente, pues existe un alto riesgo de que los vasos se encuentren adheridos a la superficie interna de la paquimeninge (Hernesniemi 2010). La rotura inintencionada de una vena de drenaje única durante la fase extradural de la cirugía, puede conducir a la congestión de la MAV y al desencadenamiento de una situación de emergencia vital para el paciente.TECNICA MICROQUIRURGICA.El tratamiento microquirúrgico de las MAVs se compone de tres pasos fundamentales (Hasimoto et al; 2007): 1) La disección "cortante" (sharp) de los surcos, cisuras y/ o cisternas para identificar y controlar la porción proximal de las aferencias arteriales; 2) La disección "roma" (blunt) y sin uso de coagulación del nido; y 3) La división del drenaje venoso. Durante la disección de la aracnoides con microtijeras [Figura 7 jpg] se identifica secuencialmente la porción proximal de las aferencias arteriales fundamentales; éstas pueden ser clipadas temporalmente para continuar la disección en sentido distal hacia el nido [Figura 8 jpg]. El momento del clipaje debe anotarse, procediéndose a monitorizar el tiempo de oclusión arterial. A continuación, a medida que se diseca el nido, se procede a la identificación y obliteración, bien mediante clipaje o coagulación, únicamente de las arterias que penetran en el nido, respetando las arterias "de paso" que nutren el parénquima encefálico adyacente. Finalmente, se retira la obliteración temporal proximal, restaurando el flujo sanguíneo en estas últimas arterias. La desconexión secuencial de las aferencias arteriales del nido producen una disminución de la presión del mismo y aseguran un mejor control hemostásico en caso de sangrado. En este sentido, se recomienda que la disección del nido discurra de forma circunferencial y se lleve a cabo con el mínimo uso de la coagulación bipolar, para evitar la perforación inintencionada del nido y la obliteración accidental precoz de venas de drenaje [Figura 9 jpg]. Un buen indicador de que la disección se lleva a cabo de forma apropiada es la transformación de la MAV en un balón desinflado, debido a la disminución progresiva del aporte arterial y a la conservación del drenaje venoso intranidal. En el caso de haberse producido fenómenos de microhemorragia, el procedimiento microquirúrgico se ve facilitado por la presencia de un área de tejido grisáceo con depósitos focales de hemosiderina en la interfase entre la MAV y la sustancia blanca, que se corresponde con un plano de gliosis rectiva perinidal [Figura 10 jpg].En el estadío final de la cirugía, es común la aparición de aferencias profundas periventriculares. Se trata de pequeños vasos frágiles, de paredes finas, que se retraen durante la coagulación y parecen escapar a la pinza bipolar, dando lugar a una extenuante persecución a través de la sustancia blanca, justo en el momento de mayor cansancio del cirujano. La actitud errónea de taponar estos vasos con material hemostático puede dar lugar a fenómenos hemorrágicos intraventriculares o intraparenquimatosos en el periodo postoperatorio. Algunos autores recomiendan abrir el ventrículo para controlar el sangrado (Hasimoto et al; 2007), mientras que otros abogan por la eficacia de la técnica de "coagulación sucia", que consiste en aplicar una pinza bipolar de extremo romo y grueso, que abarque el vaso a coagular incluído en un pequeño volumen de parénquima encefálico (Hernesniemi; 2010).COMPLICACIONES.Los fenómenos adversos relacionados con la intervención quirúrgica pueden presentarse durante el mismo acto quirúrgico o en el periodo postoperatorio inmediato. Las complicaciones más frecuentes en ambos periodos tienen que ver con los fenómenos hemorrágicos - cuya causa más frecuente suele ser la persistencia de nido residual - y los eventos isquémicos, que habitualmente responden a una oclusión errónea o inintencionada de vasos arteriales no malformativos o "de paso", que discurren en las inmediaciones de la malformación. La aparición de edema encefálico o fenómenos hemorrágicos inesperados en el periodo postquirúrgico, una vez descartada la presencia de nido residual, pueden responder al fenómeno denominado normal perfusion pressure breaktrough (Spetzler et al; 1978). Dicho fenómeno se basa en una alteración en la autorregulación de los vasos cercanos a la MAV debida a hipoperfusión crónica (grandes, de alto flujo), de forma que la embolización o resección de las mismas produce un incremento súbito del flujo de estos vasos, pudiendo dar lugar a edema o hemorragia cerebral.CONSIDERACIONES ESPECIALES. Tratamiento quirúrgico urgente de las MAVs cerebrales.Es el caso de las MAVs cerebrales que debutan produciendo una hemorragia intracraneal. El objetivo del tratamiento quirúrgico urgente consiste en actuar de forma rápida para solucionar una situación de compromiso vital para el paciente. Por lo tanto, es común que estas intervenciones se lleven a cabo con una información prequirúrgica incompleta - en el caso de no disponer de un equipo de neurorradiología intervencionista - y por el neurocirujano de guardia, que puede carecer de experiencia amplia en el tratamiento de la patología vascular cerebral. En otras ocasiones, debido a la oclusión del nido vascular por la hemorragia, la MAV constituirá un hallazgo diagnóstico intraoperatorio. Durante el acto quirúrgico, la descompresión del parénquima encefálico constituye el objetivo prioritario. El abordaje subsiguiente de la MAV precisa una serie de consideraciones sobre los cambios estructurales que pueden producirse tras un fenómeno hemorrágico. En ocasiones, la hemorragia produce un efecto beneficioso para el desarrollo de la cirugía, ya que crea un plano de disección entre la MAV y el parénquima encefálico adyacente. Sin embargo, la presencia de una colección hemática de gran volumen puede desorientar al cirujano, al desplazar u ocluír un nido vascular que, además, puede ver modificada su posición a medida que se producen variaciones en el volumen del hematoma durante la cirugía. En estos casos, resulta prudente realizar la evacuación del hematoma, explorar la cavidad residual y, en caso de no hallar estructuras sospechosas o dudar de la angioestructura de la MAV que se está visualizando, postponer el tratamiento de la misma hasta obtener un estudio neurorradiológico completo. Otra opción es la realización de una angiografía de fluorescencia con indocianina, que ha mostrado su utilidad para la identificación de una MAV rota en la pared de la cavidad residual del hematoma (Killory et al; 2009). La [Figura 11 jpg] corresponde a un paciente joven, que debutó con un cuadro de disminución brusca del nivel de consciencia, producido por un voluminoso hematoma parietal derecho. El angio-TC urgente mostró una posible malformación vascular parietal mesial, que no pudo ser identificada durante la evacuación del hematoma. Una vez estabilizado el paciente, se realizó una arteriografía cerebral que mostró una pequeña MAV dependiente de la arteria cerebral posterior derecha, con un nido de 1 cm de diámetro y drenaje venoso único hacia el seno sagital superior. La lesión fue resecada en una segunda intervención. Cirugía de las MAVs cerebrales tratadas previamente de forma no quirúrgica.La embolización ha posibilitado el abordaje quirúrgico de MAVs antaño consideradas inoperables incluso en las manos de lo neurocirujanos más experimentados. La [Figura 12 jpg] se corresponde con el ejemplo quirúrgico presentado en las figuras 7-10. Se trata de una MAV temporo-parietal derecha gigante, con aferencias de las arterias cerebrales media y posterior ipsilaterales, y drenajes venosos múltiples hacia el seno sagital superior. Tras varias sesiones de embolización, el tamaño del nido pudo ser reducido un 50%, haciendo posible un tratamiento quirúrgico más seguro. Por otra parte, la embolización da lugar a una serie de modificaciones estructurales en la MAV que deben tenerse en consideración durante el acto quirúrgico. Aunque la atención debe focalizarse en la porción permeable de la MAV, la lesión debe exponerse de forma amplia y completa, ya que pueden existir resíduos permeables de nido o vasos neoformados bajo áreas aparentemente embolizadas, por lo que se recomienda disponer durante el acto quirúrgico de las angiografías pre y postembolización (Natarajan et al; 2008). Las áreas embolizadas del nido serán fácilmente identificables, debido a su coloración y mayor consistencia. Su presencia asegura que la disección de estas áreas de la MAV entraña un riesgo mínimo de hemorragia.La segunda condición que merece una consideración especial es la cirugía de aquellas MAVs que fueron tratadas mediante radiocirugía estereotáctica, bien de forma incompleta o sin éxito, y/ o que continúan siendo sintomáticas. En estos casos, el cirujano debe enfrentarse a una lesión alterada estructuralmente: una aracnoides engrosada, la modificación del patrón de aferencias arteriales por fenómenos de neoangiogénesis y una estenosis fibrótica del sistema venosos de drenaje pueden incrementar de forma notable la complejidad de la la técnica quirúrgica, ensombreciendo el pronóstico funcional (Steinberg et al; 1996, Asgari et al; 2010).BIBLIOGRAFÍA:1) Asgari S, Bassiouni H, Gizewski E, van de Nes JAP, Stolke D, Sandalcioglu IE (2010) AVM resection after radiation therapy-clinico morphological features and microsurgical results. Neurosurg Rev 33: 53-61.2) Bambakidis NC, Sunshine JL, Faulhaber PF, Tarr RW, Selman WR, Ratcheson RA (2001) Functional evaluation of arteriovenous malformations. Neurosurg Focus 11(5): article 2, 1-5.3) Dempsey RJ, Moftakhar R, Pozniak M (2004) Intracranial Doppler to measure cerebrovascular resistance as a guide to complete resection of arteriovenous malformations. Neurosurgery 55: 155-161.4) Fleetwood IG, Stelnberg GK (2002) Arteriovenous malformations. Lancet 359: 863-873.5) Hasimoto N, Nozaki K, Takagi Y, Kikuta K, Mikuni N (2007) Surgery of cerebral arteriovenous malformations. Neurosurgery 61 (SHC Suppl 1): 375-389.6) Hernesniemi J, Romani R, Lehecka M, Isarakul P, Dashti R, Celic O et al (2010) Present state of microsurgery for cerebral arteriovenous malformations. Acta Neurochir (Suppl) 107 : 71-76.7) Hoh BL, Chapman PH, Loeffler JF, Carter BS, Ogilvy CS (2002) Results of multimodality treatment for 141 patients with arteriovenous malformations and seizures: factors associated with seizure incidence and seizure outcomes. Neurosurgery 51: 303-311.8) Killory BD, Nakaji P, Gonzales LF, Ponce FA, Wait SD, Spetzler RF (2009) Prospective evaluation of microscope-integrated intraoperative near-infrared indocyanine green angiography during cerebral arteriovenous malformation surgery. Neurosurgery 65: 456-462.9) Kim B, Sarma D, Lee SK, terBrugee KG (2009) Brain edema associated with unruptured brain arteriovenous malformations. Neuroradiology 51: 327-335.10) Lazar RM (2001) Neuropsychological function and brain arteriovenous malformations: redefining eloquence as a risk fro treatment. Neurosurg Focus 11(5): article 4, 1-4.11) Leclerc X, Gauvrit JY, Trystram D, Reyns N, Pruovo JP, Meder JF (2004) Cerebral arteriovenous malformations: value of the non invasive vascular imaging techniques. J Neuroradiol 31: 349-358.12) Moftakhar P, Hauptman JS, Malkasian D, Martin NA (2009) Cerebral arteriovenous malformations. Part 1: cellular and mollecular biology. Neurosurg Focus 26(5): E10.13) Moftakhar P, Hauptman JS, Malkasian D, Martin NA (2009) Cerebral arteriovenous malformations. Part 2: physiology. Neurosurg Focus 26(5): E11.14) Natarajan SK, Ghodke B, Britz GW, Born DE, Sekhar LN (2008) Multimodality tratment of brain arteriovenous malformations with microsurgery after embolization with onyx: single-center experience and technical nuances. Neurosurgery 62: 1213- 1226.15) Ng I, Hwang PYK, Kumar D, Lee CK, Kockro RA, Sitoh YY (2009) Surgical planning fro microsurgical excision of cerebral arterio-venous malformations using virtual reality technology. Acta Neurochir 151: 453-463.16) Riina HA, Gobin YP (2001) Grading and surgical planning for intracranial arteriovenous malformations. Neurosurg Focus 11(5): article 3, 1-4.17) Scramm J, Clusmann H (2008) The surgery of epilepsy. Neurosurgery 62 (SHC Suppl 2): 463-481.18) Spetzler RF, Wilson CB, Weinstein P, Mehdorn M, Townsend J, Telles D (1978) Normal perfusion pressure breaktrough theory. Clin Neurosurg 25: 651-672.19) Spetzler RF, Martin NA (1986) A proposed grading system for arteriovenous malformations. J Neurosurg 65: 476-483.20) Steinberg GK, Chang SD, Levy RP, Marks MP, Frankel K, Marcellus M (1996) Surgical resection of large incompletely treated intracranial arteriovenous malformations following stereotactic radiosurgery. J Neurosurg 84: 920-928.21) Unlu E, Temizoz O, Albayram S, Genchellac H, Hamamcioglu MK, Kurt I, et al (2006) Contrast-enhanced MR 3D angiography in the assessment of brain AVMs. Eur J Radiol 60 (3): 367-378.22) Yeh HS, Kashiwagi S, Tew JM, Berger TS (1990) Surgical management of epilepsy associated with cerebral arteriovenous malformations. J Neurosurg 72: 216-223.- 28342 lecturas