Ictus de base genética: Enfermedad de Fabry
INTRODUCCIÓNLa Enfermedad de Fabry (EF) es una entidad rara, multisistémica, incluida en el grupo de enfermedades por depósito lisosomal de origen genético-hereditario. La alteración en el gen de la alfa-galactosidasa A, situado en el cromosoma X (Xq22.1), se traduce en un déficit de actividad de dicha enzima, que está implicada en el catabolismo de los glucoesfingolípidos. Esta deficiencia causa acumulación progresiva de esfingolípidos neutros parcialmente metabolizados (entre los cuales predomina la globotriaosilceramida-Gb3), principalmente en músculo liso y endotelio vascular de diferentes tejidos como piel, córnea, riñón, corazón y sistema nervioso, y es responsable de las manifestaciones de la enfermedad. EPIDEMIOLOGÍASe trata de una enfermedad infrecuente, con una incidencia de 1 caso por cada 476.000 habitantes (1/238000 varones), probablemente infraestimada por la existencia de formas oligosintomáticas y de inicio tardío [Poorthuis BJ et al, 1999]. Como en todas las enfermedades con un patrón de herencia ligado al cromosoma X los varones desarrollan la enfermedad con mayor expresividad clínica que las mujeres, que son portadoras heterocigotas, aunque hasta en el 60-70% también refieren síntomas clínicos típicos e incluso pueden padecer formas graves de la enfermedad. Este hecho se explica por el proceso de lionización, es decir, anulación funcional aleatoria de uno de los cromosomas X [MacDermot KD; 2001]. En ambos sexos se ha observado una disminución de la supervivencia media por afectación renal, cardiovascular y/o cerebrovascular esencialmente, encontrándose alrededor de los 47 años en varones y 70 años en mujeres.MANIFESTACIONES CLÍNICASLa gravedad clínica de la enfermedad se encuentra directamente relacionada con el grado de déficit de actividad de la enzima alfa-galactosidasa, de manera que cuando es inferior al 1% da lugar a la forma clásica y severa de la enfermedad, mientras que si se encuentra entre el 1-30% aparecen formas incompletas con afectación principalmente cardiaca o renal.En la variante clásica, los primeros síntomas suelen aparecer en la infancia y adolescencia, siendo característicos los angioqueratomas difusos y las acroparestesias que son episodios transitorios de dolor neuropático en manos y pies, resistente a la analgesia habitual, que suelen desencadenarse por cambios de temperatura, ejercicio y/o estrés emocional y que en ocasiones se acompañan de fiebre de origen incierto autolimitada. También pueden referir dolor de origen osteoarticular, hipohidrosis, trastornos gastrointestinales inespecíficos, diarrea, fallo de medro y déficit visual por compromiso de córnea o cristalino (es típica la cornea verticillata, aunque no específica). Debido al desconocimiento médico general de la enfermedad, dada su rareza, y a la normalidad de los estudios analíticos y de imagen iniciales, en ausencia de historia familiar conocida se produce un importante retraso en el diagnóstico, que se prolonga hasta que aparecen las manifestaciones renales, cardiovasculares y cerebrovasculares a partir de la 3ª década de la vida (ver Tabla 1 jpg) [Mehta A; 2004, Joe T.R.; 2007, Juri AZ;2008]. La prevalencia de esta forma clásica de presentación de la EF se sitúa entre 1/40.000 varones y 1/117.000 en la población general [Mehta A;2004].
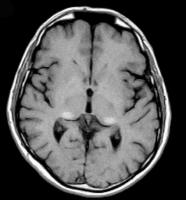
ENFERMEDAD CEREBROVASCULAREl ictus es una causa importante de morbimortalidad en la EF y es considerado una de sus manifestaciones mayores. Afecta según las series a un 13-25% de estos pacientes y aparece a edades más tempranas que en la población general (media de 39 años en varones; 46 años en mujeres), pese a que el riesgo aumenta con los años. Mayoritariamente son de origen isquémico (87%), por enfermedad de pequeño vaso cerebral (lacunar) y pueden afectar a cualquier territorio vascular, aunque hay revisiones que sugieren una preferencia por territorio vertebrobasilar [Grewal RP et al;1992, Sims K. et al;2009, Mitsias P. et al;1996]. También podemos encontrar, con menor frecuencia, ictus de gran vaso de origen embólico; cardioembólico en pacientes con afectación cardiaca (arritmias, valvulopatía y/o cardiopatía isquémica) o arterio-arterial desde eje carotídeo o vertebro-basilar anómalos, siendo característica la dolicoectasia basilar.En casi la mitad de los pacientes con EF que sufren su primer ictus se desconoce el diagnóstico, particularmente en mujeres y en menores de 30 años, bien porque no han desarrollado aún afectación cardiaca y/o renal o porque ésta es clínicamente silente [Sims K. et al;2009]. Se han realizado varios estudios prospectivos en varones jóvenes con ictus de origen desconocido con el objetivo de determinar la prevalencia de EF en este grupo poblacional y el potencial beneficio del cribado de la enfermedad en los mismos. Los resultados han sido controvertidos. Según el grupo alemán de Rolfs et al. hasta el 4,9% de los varones y el 2,4% de las mujeres con ictus criptogénicos, en edades comprendidas entre los 18 y los 55 años, fueron diagnosticados genéticamente de EF, lo que significaría al extrapolarlo a la población general que la prevalencia de EF en jóvenes con ictus sería del 1 al 2% [Rolfs A. et al;2005]. Aunque estos datos no han sido corroborados en ninguno de los estudios realizados posteriormente [Segura T. et al;2006, Brouns R. et al,2007, Baptista MV et al;2010, Wozniak MA;2010, Brouns R. et al 2010], se ha sugerido que la actividad deficiente de la alfa-galactosidasa puede jugar un papel significativo en el 1% de jóvenes con enfermedad cerebrovascular incluyendo ictus isquémico, hemorrágico, trombosis venosa cerebral, alteraciones macrovasculares como dolicoectasia basilar y alteraciones inespecíficas en la sustancia blanca [Brouns R. et al;2010].FISIOPATOLOGIA DE LA ENFERMEDAD CEREBROVASCULARSe postula que el mecanismo fisiopatológico que subyace a la vasculopatía cerebral en la EF, que es principalmente una microangiopatía, es complejo y multifactorial, estando implicados además de la lesión directa de la pared vascular por el acúmulo de glucoesfingolípidos, la presencia de una situación procoagulante (posiblemente determinada genéticamente) y la alteración de la hemodinámica cerebral [Mendióroz M;2006, DeGraba T. et al;2000, Moore DF et al;2003].Son varios los estudios que han analizado el patrón de perfusión cerebral y la vasorreactividad mediante Doppler transcraneal en pacientes con enfermedad de Fabry. Aunque los resultados son controvertidos, parece existir acuerdo en la presencia de una hiperperfusión predominantemente en la circulación posterior, no relacionada con un aumento del metabolismo cerebral en dichas áreas, que estaría en concordancia por una parte con la presencia de dolicoectasia basilar y por otra con los hallazgos de la neuroimagen como son la hiperseñal en secuencia T1 de la región posterior del tálamo o pulvinar ( signo altamente específico de EF, ver Figura 1 jpg) y de la sustancia blanca periventricular posterior, con calcificaciones de forma ocasional [Moore DF et al; 2003a, Moore DF et al 2003b, Fellgiebel A et al; 2009]. Por otro lado, se ha objetivado un aumento significativo de la reactividad vascular cerebral que podría estar en relación con disfunción autonómica y endotelial, a través de vías independientes del óxido nítrico. En un estudio reciente se ha probado que existe un aumento de la liberación de especies reactivas de oxígeno, lo que conlleva un aumento del estrés oxidativo celular con formación de peroxinitrito (ONOO-) que condiciona una vasodilatación permanente y además podría acelerar el proceso de arterioesclerosis [Moore DF et al;2001, Moore DF et al 2007]. Aunque hasta el momento actual no disponemos de parámetros de laboratorio, ni hallazgos de neuroimagen o neurosonológicos que nos ayuden a predecir que pacientes con EF sufrirán un ictus, si se han detectado tres factores de riesgo clínico más frecuentes en ellos, como son la hipertensión arterial, arritmias cardíacas y los antecedentes de ataques isquémicos transitorios. En presencia de alguno de estos factores debemos esforzarnos en instaurar un tratamiento preventivo adecuado e incluso plantear la terapia enzimática sustitutiva [Sims K et al;2009]. DIAGNÓSTICOAnte la sospecha clínica de EF se debe realizar un estudio bioquímico que analice la actividad de alfa-galactosidasa en los leucocitos o en su defecto en el plasma del paciente. En caso de resultado normal se pueden determinar los niveles de Gb3 en plasma y orina. Las mujeres portadoras precisan una confirmación genética ya que la actividad de la enzima suele encontrarse hasta en 1/3 de los casos dentro de la normalidad. Una vez establecido el diagnóstico se debe realizar un seguimiento protocolizado del paciente para monitorizar las complicaciones de la enfermedad (Tabla 2) [Joe TR et al;2007, Yuri AZ et al;2008, guía clínica GETEF].Como en todas las enfermedades genéticas no debemos olvidar el estudio de posibles familiares afectados, el consejo genético y el diagnóstico prenatal.TRATAMIENTOLas medidas de Prevención primaria y secundaria de los eventos isquémicos cerebrovasculares, como son el control de factores de riesgo cardiovascular, la antiagregación y la anticoagulación, tienen las mismas indicaciones en la EF que en el resto de la población. El tratamiento específico de la EF es la terapia enzimática sustitutiva (TSE), que fue aprobada en 2001 y 2003 por la EMEA y FDA respectivamente (Ver Tabla 3 jpg). Existen dos preparados comercializados con efectos terapéuticos comparables, la agalsidasa y la agalsidasa . Son enzimas recombinantes que han demostrado en estudios bien diseñados efectos clínicos beneficiosos significativos, con mejoría de la función renal y/o hipertrofia cardiaca, del dolor y de la calidad de vida en pacientes afectados y retraso de la aparición de dichas manifestaciones en asintomáticos [Mehta A et al ;2009, Banikazemi M;2007 et al, Schiffmann R et al ;2001]. Desde punto de vista fisiopatológico, disminuyen la acumulación del glicoesfingolípido Gb3 en los vasos de riñones, corazón y pie. A nivel de sistema nervioso central esta teoría no se ha podido demostrar, aunque disponemos de datos indirectos gracias a los hallazgos de resonancia magnética [Jardim L et al;2004] y neurodoppler que apuntan hacia una posible mejoría, ya que consigue tras 6 meses de tratamiento normalizar el flujo sanguíneo cerebral previamente patológico [Jardim L et al;2001, Moore DF et al;2002]. Los criterios necesarios para iniciar este tratamiento según la guía clínica española se recogen en la Tabla 4. BIBLIOGRAFÍA• Banikazemi M, Bultas J, Waldek et al (2007). Agalsidase-Beta Therapy for Advanced Fabry Disease. A Randomized Trial. Ann Intern;146:77-86• Baptista MV, Ferreira S, Pinho-e-Melo T, Carvalho M, Cruz VT, Carmona C, et al (2010). Mutations of the GLA gene in young patients with stroke: the PORTYSTROKE study—screening genetic conditions in Portuguese young stroke patients. Stroke;41:431-6• Brouns R, Sheorajpanday R, Braxel E, Eyskens F, Baker R, Hughes D et al (2007). Middelheim Fabry Study (MiFaS): A retrospective Belgian study on the prevalence of Fabry disease in young patients with cryptogenic stroke. Clin Neurol Neurosurg;109:479-484• Brouns R, Thijs V, Eyskens F, Van den Broeck M, Belachew S, Van Broeckhoven C et al (2010). Belgian Fabry Study. Prevalence of Fabry disease in a cohort of 1000 young patient with cerebrovascular disease. Stroke.• DeGraba T, Azhar S, Dignat-George F, Brown E, Boutière B, Altarescu G, McCarron R, Schiffmann R. (2000). Profile of endothelial and leukocyte activation in Fabry patients. Ann Neurol; 47:229-33• Fellgiebel A, Keller I, Marin D, Müller MJ, Schermuly I, Yakushev I et al (2009). Diagnostic utility of different MRI and MR angiography measures in Fabry. Neurology;72:63-68• Fellgiebel A, Mazanek M, Whybra C, Beck M, Hartung R, Muller KM, et al (2006). Pattern of microstructural brain tussue alterations in Fabry disease. A diffusion-tensor imaging study. J Neurol;253:780-7• Guía Clínica para el Estudio y Tratamiento de la Enfermedad de Fabry. GETEF (2005)• Grewal RP, Barton NW (1992). Fabry´disease presenting with stroke. Clin Neurol Neurosurg;94(2):177-9• Hilz MJ, Kolodny EH, Brys M, Stemper B, Haendl T, Marthol H.(2004) Reduced cerebral blood flow velocity and impaired cerebral autoregulation in patients with Fabry disease. J Neurol; 251:564-70.• Jardim L, Scott LTC, Gladwin MT, Altarescu G, Kaneski C, Suzuki K et al (2001). Regional cerebral hiperperfusión and nitric oxide pathway disregulation in Fabry disease: Reversal by enzyme replacement therapy. Circulation;104:1506-1512• Jardim L, Vedolin L, Schwartz IV, Burin MG, Cecchin C, Kalakum L, et al (2004). CNS involvement in Fabry disease: clinical and imaging studies before and after 12 months of enzyme replacement therapy. J Inherit Metab Dis;27:229-40• Joe T.R. Clarke (2007). Narrative Review: Fabry Disease. Ann Intern Med;146:425-433.• MacDermot KD, Holmes A, Miners AH. Anderson-Fabry disease (2001): clinical manifestations and impact of disease in a cohort of 60 obligate carrier females. J Med Genet;38:769-75• Mehta A, Ricci R, Widmer U, Dehout F, Garcia de Lorenzo A, Kampmann C, et al (2004). Fabry disease defined: baseline clinical manifestations of 366 patients in the Fabry Outcome Survey. Eur J Clin Invest;34:236-42.• Mehta A, Beck M, Elliott P, Giugliani R, Linhart A, Sunder-Plassmann et al (2009). Enzyme replacement therapy with agalsidase alfa in patients with Fabry´s disease: an analysis of registry data. Lancet;374:1986-96• Mendióroz M, Fernández IC, Montaner J (2006). Manifestaciones neurológicas de la enfermedad de Fabry. Rev Neurol;43:739-45• Mitsias P, Levine SR (1996). Cerebrovascular complications of Fabry´s disease. Ann Neurol;40:8-17• Moore DF, Altarescu G, Barker WC, Patronas NJ, Herscovitch P, Schiffmann R (2003a). White matter lesions in Fabry disease occur in “prior” selectively hypometabolic and hyperperfused brain regions. Brain Res Bull;62:231-40• Moore DF, Altarescu G, Ling GSF, Jeffries N, Frei KP, Weibel T et al (2002). Elevated cerebral blood flow velocities in Fabry disease with reversal after enzyme replacement. Stroke;33:525-531• Moore DF, Kaneski CR, Askari H, Schiffmann R (2007). The cerebral vasculopathy of Fabry disease. J Neurol Sci;257:258-263• Moore DF, Ye F, Schiffmann R, Butman JA (2003b). Increased signal intensity in the pulvinar on T1-weighted images: a pathognomonic MR imaging sign of Fabry disease. AJNR Am J Neuroradiol;24:1096-101• Poorthuis BJ, Wevers RA, Kleijer WJ, Groener JE, De Jong JG, Van Weely S, et al (1999). The frequency of lysosomal storage diseases in The Netherlands. Hum Gen;105:151-6• Rolfs A, Böttcher T, Zschiesche M, Morris P, Winchester B, Bauer P, et al (2005). Prevalence of Fabry disease in patients with cryptogenic stroke: a prospective study. Lancet;366:1794-96• Schiffmann R, Kopp JB, Austin HA III, Sabnis S, Moore DF, Weibel T, et al (2001). Enzyme replacement therapy in Fabry disease: a randomized controlled trial. JAMA;285:2743-9• Segura T, Barba M.A, Ayo O, Rallo B (2006). Prevalence of Fabry Disease in Spanish patients with Criptogenic Stroke. Cerebrovas Dis :21(suppl 4):95• Sims K, Politei J, Banikazemi M, Lee P (2009). Stroke in Fabry Disease Frequently Occurs Before Diagnosis and in the Absence of Other Clinical Events: Natural History Data From the Fabry Registry. Stroke;40:788-794• Wozniak MA, Kittner SJ, Tuhrim S, Cole JW, Stern B, Dobbins M, et al (2010). Frequency of Unrecognized Fabry Disease Among Young European-American and African-American Men With First Ischemic Stroke. Stroke;41:78-81• Yuri A.Z, Robert J hopkin (2008). Lysosomal Storage Disease 3. Fabry´s disease. Lancet;372:1427-35.- 24209 lecturas