Hemorragia Intraventricular
INTRODUCCIÓN
La aparición de sangre en el sistema ventricular se denomina hemorragia intraventricular (HIV). La forma más común es por invasión del sistema ventricular en el seno de hematomas intraparenquimatosos vecinos o hemorragia subaracnoidea (HIV secundaria). Existe también una forma de HIV primaria en la que se observa sangre únicamente en el sistema ventricular.
Es importante identificar la causa subyacente de la hemorragia por las implicaciones terapéuticas que conlleva. La principal complicación de este tipo de sangrado, independientemente de la causa, es el desarrollo de hidrocefalia por disminución de la reabsorción del líquido cefalorraquídeo (LCR), que en la fase aguda puede presentarse como un cuadro de hipertensión intracraneal (HTIC), y en la fase crónica como un cuadro de hidrocefalia a presión normal.
El tratamiento de los pacientes sintomáticos que desarrollan hidrocefalia consiste en la colocación de un sistema derivativo de LCR, inicialmente puede bastar con insertar un drenaje ventricular externo (DVE), pero de forma tardía puede ser precisa una válvula ventrículoperitoneal, ventrículoauricular o lumboperitoneal. En ocasiones la cateterización ventricular no consigue resolver la hidrocefalia debido a que el acúmulo de sangre en el sistema ventricular forma un coágulo por lo que se ha empleado con éxito el lavado del catéter con dosis pequeñas de fibrinolíticos para facilitar la permeabilidad del drenaje.
EPIDEMIOLOGÍA
La HIV primaria es una entidad infrecuente que supone únicamente el 3.1% de las hemorragias intracerebrales espontáneas (Darby DG et al; 1988a), motivo por el cual se desconoce en cierta medida la etiología, características clínicas y pronóstico a corto y largo plazo (Martí-Fàbregas J et al; 1999a). Diversos autores han publicado series de casos en los que la hipertensión arterial (HTA) juega un papel importante en el desarrollo de HIV primaria. Apenas hay diferencias entre ambos sexos, afectando generalmente a pacientes de mediana edad (Flint AC et al; 2008a, Giray S et al; 2009).
Las características epidemiológicas que definen la HIV secundaria son las propias de cada entidad clínica y se discutirán por separado.
ETIOLOGÍA
La HIV secundaria generalmente ocurre por extensión de sangre a los ventrículos en el caso de hemorragia subaracnoidea o por rotura directa en el sistema ventricular de un hematoma intraparenquimatoso profundo. La HIV se estima que aparece en un 40% de los pacientes con hematomas intraparenquimatosos y en un 10% en hemorragias subaracnoideas (Hanley DF et al; 2009, Nyquist P et al; 2007a).
En el caso de HIV primaria las malformaciones vasculares son la causa identificada con más frecuencia según la mayoría de los estudios, ya sean malformaciones arteriovenosas o fístulas arteriovenosas (Darby DG et al; 1988b, Flint AC et al; 2008b, Irie F et al; 2003, Passero S et al; 2002a). Otras causas demostradas son tumores intraventriculares, aneurismas intraventriculares de las arterias coroideas o lentículoestriadas, enfermedad de MoyaMoya, coagulopatías congénitas o adquiridas, apoplejía pituitaria, vasculitis, displasia fibromuscular y drogas de abuso simpaticomiméticas (Smets K et al; 2005, Vates GE et al; 2001, Jabbour R et al; 2005, Khan M et al; 2006, Challa VR et al; 1981, Kishimoto M et al; 2003, Angelopoulos M et al; 1995a, Ziai WC et al; 2003). Aproximadamente en la mitad de los casos la causa subyacente de la HIV no está identificada (Martí-Fàbregas J et al; 1999b, Passero S et al; 2002b).
MANIFESTACIONES CLÍNICAS
La presencia de sangre en el sistema ventricular es responsable de una serie de manifestaciones clínicas bien definidas, ya sea en caso de HIV primaria o secundaria. Cuando la causa subyacente sea una hemorragia subaracnoidea o un hematoma intraparenquimatoso con extensión al sistema ventricular la presentación clínica tendrá peculiaridades inherentes a cada entidad que se discutirán en los apartados correspondientes.
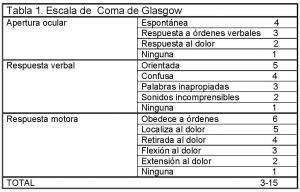
Los pacientes con HIV primaria generalmente debutan de forma brusca con cefalea, a menudo asociada a náuseas, vómitos y disminución del nivel de conciencia. El deterioro neurológico se valora mediante la escala de Glasgow Coma Scale (GCS) y tiene implicaciones pronósticas (Tabla 1). Los déficits neurológicos focales así como las crisis comiciales no son frecuentes. La presencia de sangre en el sistema ventricular en contacto con el LCR puede provocar rigidez de nuca y meningismo en la exploración física (Flint AC et al; 2008c, Martí- Fàbregas Jet al; 1999c, Angelopoulos M et al; 1995b).
Como consecuencia de la irrupción de la sangre al sistema ventricular se produce un aumento de la presión intracraneal con el consiguiente deterioro neurológico. La principal complicación de este tipo de sangrado es el desarrollo de hidrocefalia por disminución de la reabsorción del LCR pudiendo desarrollar un cuadro de HTIC en fase aguda (Passero S et al; 2002c, Kofke WA; 2002).
Cuando la causa de la HIV es una malformación vascular o en el seno de una coagulopatía aumenta el riesgo de resangrado que en algunas series alcanza incluso el 20%. El vasoespasmo que es frecuente en caso de HIV secundaria a hemorragia subaracnoidea, es poco común en caso de HIV primaria (Nyquist P et al; 2007b, Gerard E et al; 2007).
Otras complicaciones sistémicas son frecuentes desde el inicio de los síntomas e incluyen inestabilidad hemodinámica, arritmias cardiacas, fiebre, neumonía broncoaspirativa, alteraciones hidroelectrolíticas, trombosis venosa profunda, embolismo pulmonar y sangrado gastrointestinal, entre otras.
DIAGNÓSTICO
La prueba de imagen de elección para el diagnóstico de la HIV es la Tomografía Axial Computarizada (TAC) sin contraste. Es útil para filiar la etiología en la mayoría de los casos de forma rápida y fiable. La presencia de sangre en las cisternas basales o surcos corticales nos debe hacer sospechar una hemorragia subaracnoidea. De la misma forma, se puede diagnosticar el tamaño y localización de un hematoma intraparenquimatoso con extensión al sistema ventricular.
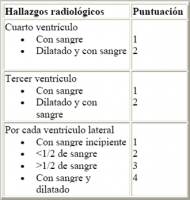
Se han descrito varias herramientas para cuantificar la extensión de la HIV mediante TAC. La más frecuente es el Graeb Score que establece una clasificación en función de la extensión de la hemorragia, con buena correlación con el nivel de conciencia y con implicaciones pronósticas (Graeb DA et al; 1982) (Ver Tabla 2 jpg ). Otros sistemas propuestos más recientemente son el Intraventricular Hemorrhage Score y el Intracerebral Hemorrhage Score (Hallevi H et al; 2009, Hemphill JC 3rd et al; 2001). Estos sistemas no están ampliamente implantados en la práctica diaria por su complejidad.
Tabla 2: Escala de Graeb para estratificar la gravedad de la hemorragia intraventricular.
Otras pruebas de imagen son útiles para establecer el diagnóstico de HIV, sobre todo en determinadas patologías donde la TAC no ofrece suficiente información, por ejemplo en patología vascular cerebral y en algunos tumores. En este caso son de gran utilidad la Resonancia Magnética Nuclear (RMN) y la angioRM. En ocasiones, para afianzar el diagnóstico, es preciso realizar una arteriografía como en el caso de las malformaciones vasculares (Flint AC et al; 2008d, Zhu XL et al; 1997).
TRATAMIENTO
El objetivo fundamental del tratamiento de la HIV es detener el sangrado, tratar la hidrocefalia en caso de que esté presente, y controlar la HTIC. El manejo de los pacientes con HIV y deterioro del nivel de conciencia debe hacerse en la Unidad de Cuidados Intensivos. Se deben tratar de forma enérgica las complicaciones sistémicas que puedan acaecer tales como inestabilidad hemodinámica, arritmias cardiacas, fiebre, neumonía broncoaspirativa y alteraciones hidroelectrolíticas. Es importante la profilaxis de la trombosis venosa profunda con medias de compresión elástica, así como de la hemorragia gastrointestinal. El cabecero de la cama se debe colocar a 30º del plano horizontal para optimizar la presión intracraneal y minimizar el riesgo de broncoaspiración. No es necesario el tratamiento profiláctico con fármacos anticomiciales.
Es fundamental un control estricto de la tensión arterial en este tipo de pacientes. Por un lado, parece lógico pensar que el tratamiento agresivo de la HTA minimiza el riesgo de sangrado, pero por otro lado podría ser perjudicial para el mantenimiento de la presión de perfusión cerebral (PPC). Por tanto, el manejo de la HTA en este tipo de pacientes se podría realizar según el siguiente esquema (Broderick J et al; 2007; Steiner T et al; 2006):
- Para pacientes con tensión arterial sistólica (TAS) > 200 mmHg o tensión arterial media (TAM) > 150 mmHg, considerar tratamiento agresivo de la HTA con infusión continua de fármacos antihipertensivos.
- Para pacientes con TAS > 180 mmHg o TAM > 130 mmHg, y sospecha de HTIC administrar fármacos antihipertensivos en infusión continua o intermitente para mantener la PPC entre 60 y 80 mmHg.
- Para pacientes con TAS > 180 mmHg o TAM > 130 mmHg sin evidencia de HTIC administrar fármacos antihipertensivos de forma intermitente hasta alcanzar TAS de 160 mmHg o TAM de 110 mmHg.
Los fármacos recomendados para el manejo de la HTA aparecen en la Tabla 2.
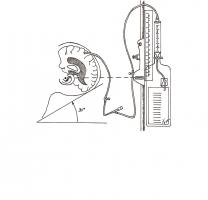
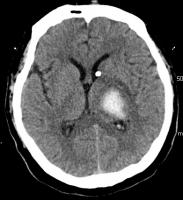
En el caso de que se desarrolle hidrocefalia con deterioro del nivel de conciencia está indicada la colocación de un DVE. Se trata de un catéter que se inserta en el sistema ventricular (generalmente en el ventrículo lateral) a través de un pequeño trépano en el cráneo, y que se conecta a un sistema colector para el drenaje de LCR. También se puede conectar a un transductor de presión para medir la presión intracraneal (Figura 1).
Las complicaciones derivadas del uso de un DVE son fundamentalmente la obstrucción y la infección. Cuando un paciente portador de un DVE desarrolle signos y síntomas compatibles con infección es recomendable la realización de un análisis y cultivo del LCR y comenzar con antibioterapia empírica. El cambio profiláctico del catéter no disminuye el riesgo de infección (Pfausler B et al; 2004, Hoefnagel D et al; 2008).
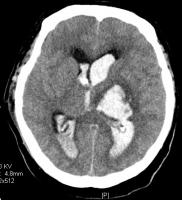
Cada vez hay más evidencia clínica acerca del uso de fibrinolíticos administrados a través del DVE para favorecer la lisis del coágulo producido por el acúmulo de sangre en el sistema ventricular. La uroquinasa se empezó a utilizar a finales de los años noventa respaldada por numerosos estudios (Naff NJ et al; 2000, Naff NJ et al; 2004a, Todo T et al; 1991, Coplin WM et al; 1998). La dosis utilizada es de 5.000 a 25.000 unidades cada 12 horas hasta la resolución del coágulo, manteniendo el DVE cerrado durante una hora después de la administración del fármaco o antes si hay una elevación de la PIC > 20 mmHg sin respuesta a otras medidas. La retirada del fármaco del mercado por problemas concernientes a su seguridad puso fin a una línea de investigación que había incorporado la uroquinasa como el fármaco de elección en el tratamiento fibrinolítico de la HIV (Nyquist P et al; 2007c). Por este motivo, se comenzó a utilizar rt-PA en las distintas series publicadas posteriormente con dosis que oscilan entre 2 y 5 mg cada 12 horas. (Fountas KN et al, 2005). No obstante, la uroquinasa volvió a entrar en el mercado surgiendo nuevos estudios con este fármaco (Naff NJ et al, 2004b). En el 2002 se realizó una revisión sistemática de cara a evaluar la seguridad y la eficacia del tratamiento fibrinolítico. Se analizaron siete estudios donde se utilizaron ambos fibrinolíticos en un total de 74 pacientes (17 pacientes se trataron con uroquinasa y 57 con rt-PA). Según las conclusiones de esta revisión no se objetivó evidencia suficiente para demostrar la eficacia del tratamiento fibrinolítico (Lapointe M et al; 2002). A la luz de todos estos resultados, se puso en marcha el mayor estudio clínico, prospectivo, randomizado realizado hasta la fecha dirigido al uso de rt-PA en humanos, es el llamado CLEAR IVH (Clot Lysis: Evaluating Accelerated Resolution of Intraventricular Hemorrhage). En este estudio se postula que la disolución del coágulo intraventricular con el uso de rt-PA podría reducir la HTIC, incrementar la PPC, disminuir el riesgo de hidrocefalia crónica y de vasoespasmo y disminuir la morbi-mortalidad. Otras cuestiones que probablemente aclare este estudio son la dosis más segura de rt-PA, el intervalo entre dosis, la duración del tratamiento y la localización del DVE (Hinson HE et al; 2007, Nyquist P et al; 2007d). En las figuras siguientes aparece una hemorragia intraventricular secundaria a un hematoma talámico izquierdo antes y después de tratamiento con rtPA intraventricular (Figuras 2 y 3).
Otras líneas de investigación abiertas en el tratamiento de la HIV son las técnicas neuroendovasculares, endoscópicas y quirúrgicas.
PRONÓSTICO
La mortalidad varía desde un 45% hasta un 80%, con una mortalidad en el primer año estimada en un 38% (Qureshi AI et al; 2001). La edad avanzada, coagulopatía, GCS menor de 8, la hidrocefalia en el momento de la presentación de los síntomas y el volumen de la HIV se asocian igualmente con mayor mortalidad (Flint AC et al; 2008e, Passero S et al; 2002d, Tuhrim S et al; 1999). A largo plazo, los pacientes que han sufrido una HIV pueden tener secuelas neurológicas, desarrollar hidrocefalia a presión normal e incluso tener otra hemorragia intracerebral.
BIBLIOGRAFÍA
Angelopoulos M, Gupta SR, Azat Kia B. (1995). Primary intraventricular hemorrhage in adults: clinical features, risk factors, and outcome. Surg Neurol. 44: 433-6.
Broderick J, Conolly S, Feldmann E, Hanley D, Kase C, Krieger D et al. (2007). Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a guideline from the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group. Stroke. 38: 2001-23; Circulation. 116: 391-413.
Challa VR, Richards F 2nd, Davis CH Jr. (1981). Intraventricular hemorrhage from pituitary apoplexy. Surg Neurol. 16: 360-1.
Coplin WM, Vinas FC, Agris JM, Buciuc R, Michael DB, Diaz FG et al. (1988). A cohort study of the safety and feasibility of intraventricular urokinase for nonaneurysmal spontaneous intraventricular hemorrhage. Stroke. 29: 1573-9.
Darby DG, Donnan GA, Saling MA. (1988). Primary intraventricular hemorrhage: clinical and neuropsychological findings in a prospective stroke series. Neurology. 38: 68-75.
Flint AC, Roebken A, Singh V. (2008). Primary intraventricular hemorrhage: yield of diagnostic angiography and clinical outcome. Neurocrit Care. 8: 330-6.
Fountas KN, Kapsalaki EZ, Parish DC, Smith B, Smisson HF, Johnston KW et al. (2005). Intraventricular administration of rt-PA in patients with intraventricular hemorrhage. South Med J. 98: 767-73.
Gerard E, Frontera JA, Wright CB. (2007). Vasospasm and cerebral infarction following isolated intraventricular hemorrhage. Neurocrit Care. 7: 257-9.
Giray S, Sen O, Sarica FB, Tufan K, Karatas M, Goksel BK et al. (2009). Spontaneous primary intraventricular hemorrhage in adults: clinical data, etiology and outcome. Turk Neurosurg. 19: 338-44.
Graeb DA, Robertson WD, Lapointe JS, Nugent RA, Harrison PB. (1982). Computed tomographic diagnosis of intraventricular hemorrhage. Etiology and prognosis. Radiology. 143: 91-6.
Hallevi DF, Dar NS, Barreto AD, Morales MM; Martin-Schild S, Abraham AT et al. (2009). The IVH score: a novel tool for estimating intraventricular hemorrhage volume: clinical and research implications. Crit Care Med. 37: 969-74.
Hanley DF. (2009). Intraventricular hemorrhage: severity factor and treatment target in spontaneous intracerebral hemorrhage. Stroke. 40: 1533-8.
Hemphill JC 3rd, Bonovich DC, Besmertis L, Manley GT, Johnston SC. (2001). The ICH score: a simple, reliable grading scale for intracerebral hemorrhage. Stroke. 32: 891-7.
Hinson HE, Hanley DF, Ziai WC. (2010). Management of intraventricular hemorrhage. Curr Neurol Neurosci Rep. 10:73-82.
Hoefnagel D, Dammers R, Ter Laak-Poort MP, Avezaat CJ. (2008). Risk factors for infections related to external ventricular drainage. Acta Neurochir. 150: 209-14.
Irie F, Fujimoto S, Uda K, Toyoda K, Hagiwara N, Inoue T et al. (2003). Primary intraventricular hemorrhage from dural arteriovenous fistula. J Neurol Sci. 215: 115-8.
Jabbour R, Taher A, Shamseddine A, Atweh SF. (2005). Moyamoya syndrome with intraventricular hemorrhage in an adult with factor V Leiden mutation. Arch Neurol. 62: 1144-6.
Khan M, Novakovic RL, Rosengart AJ. (2006). Intraventricular hemorrhage disclosing neurofibromatosis 1 and moyamoya phenomena. Arch Neurol. 63:1653-4.
Kishimoto M, Arakawa KC. (2003). A patient with wegener granulomatosis and intraventricular hemorrhage. J Clin Rheumatol. 9: 354-8.
Kofke WA. (2002). Neurofisiopatología. En: Grenvik MD (Ed), Tratado de Medicina Crítica y Terapia Intensiva, (pp 1761-84). Madrid: Editorial Médica Panamericana.
Lapointe M, Haines S. (2002). Fibrinolytic therapy for intraventricular hemorrhage in adults. Cochrane Database Syst Rev. (3):CD003692.
Martí- Fàbregas J, Piles S, Guardia E, Martí-Vilalta JL. (1999). Spontaneous primary intraventricular hemorrhage: clinical data, etiology and outcome. J Neurol. 246: 287-91.
Naff NJ, Carhuapoma JR, Williams MA, Bhardwai A, Ulatowski JA, Bederson J et al. (2000). Treatment of intraventricular hemorrhage with urokinase: effects on 30-Day survival. Stroke. 31: 841-7.
Naff NJ, Hanley DF, Keyl PM, Tuhrim S, Kraut M, Bederson J et al. (2004). Intraventricular thrombolysis speeds blood clot resolution: results of a pilot, prospective, randomized, double-blind, controlled trial. Neurosurgery. 54: 577-83; discussion 583-4.
Nyquist P, Hanley DF. (2007). The use of intraventricular thrombolytics in intraventricular hemorrhage. J Neurol Sci. 261: 84-8.
Nyquist P, LeDroux S, Geocadin R. (2007). Thrombolytics in intraventricular hemorrhage. Curr Neurol Neurosci Rep. 7: 522-8.
Passero S, Ulivelli M, Reale F. (2002). Primary intraventricular haemorrhage in adults. Acta Neurol Scand. 105: 115-9.
Pfausler B, Beer R, Engelhardt K, Kemmler G, Mohsenipour I, Schmutzhard E. (2004). Cell index--a new parameter for the early diagnosis of ventriculostomy (external ventricular drainage)-related ventriculitis in patients with intraventricular hemorrhage?. Acta Neurochir. 146: 477-81.
Qureshi AI, Tuhrim S, Broderick JP, Batjer HH, Hondo H, Hanley DF. (2001). Spontaneous intracerebral hemorrhage. N Engl J Med. 344:1450-60.
Smets K, Salgado R, Simons PJ, De Clercq R, De Smedt K, Cras P. (2005). Central neurocytoma presenting with intraventricular hemorrhage: case report and review of literature. Acta Neurol Belg. 105: 218-25.
Steiner T, Kaste M, Forsting M, Mendelow D, Kwiecinski H, Szikora I et al. (2006). Recommendations for the management of intracranial haemorrhage - part I: spontaneous intracerebral haemorrhage. The European Stroke Initiative Writing Committee and the Writing Committee for the EUSI Executive Committee. Cerebrovasc Dis. 22: 294-316.
Todo T, Usui M, Takakura K. (1991). Treatment of severe intraventricular hemorrhage by intraventricular infusion of urokinase. J Neurosurg. 74:81-6.
Tuhrim S, Horowitz DR, Sacher M, Godbold JH. (1999). Volume of ventricular blood is an important determinant of outcome in supratentorial intracerebral hemorrhage. Crit Care Med. 27:617-21.
Vates GE, Arthur KA, Ojemann SG, Williams F, Lawton MT. (2001). A neurocytoma and an associated lenticulostriate artery aneurysm presenting with intraventricular hemorrhage: case report. Neurosugery. 49: 721-5.
Ziai WC, Triantaphyllopoulou A, Razumovsky AY, Hanley DF. (2003). Treatment of sympathomimetic induced intraventricular hemorrhage with intraventricular urokinase. J Stroke Cerebrovasc Dis. 12: 276-9.
Zhu XL, Chan MS, Poon WS. (1997). Spontaneous intracranial hemorrhage: which patients need diagnostic cerebral angiography? A prospective study of 206 cases and review of the literature. Stroke. 28:1406-9.
- 72444 lecturas