Oligodendroglioma (grado II)
RESUMEN
El oligodendroglioma (OD) es un glioma grado II según la clasificación de la OMS 2007. Los OD representan entre el 5 y el 20% de todos los tumores gliales, y aparecen en adultos, con un pico de incidencia entre los 35 y los 45 años. Es un tumor infiltrante, difuso, bien diferenciado, de localización habitual en la sustancia blanca de los hemisferios cerebrales, predominantemente en el lóbulo frontal. Es muy frecuente que presente calcificaciones, mejor visualizadas en TC craneal. Los OD tienen una mayor sensibilidad al tratamiento y mejor pronóstico que otros gliomas. El síntoma de presentación más frecuente son las crisis epilépticas, que suelen conducir al diagnóstico y, probablemente por este motivo, esta forma de presentación se asocia a mejor pronóstico.
La alteración genética característica de los OD es la co-delección 1p/19q, genotipo que confiere una mayor sensibilidad a los tratamientos quimio y radioterápicos y que a su vez se ha relacionado con un curso clínico mas indolente.
Las opciones terapéuticas incluyen observación, cirugía, radioterapia y quimioterapia. La observación estricta, con controles radiológicos periódicos, se recomienda en pacientes asintomáticos o mínimamente sintomáticos, e incluso en aquellos con crisis epilépticas al diagnóstico, pero bien controladas con tratamiento médico. La observación está contraindicada en aquellos pacientes cuya sintomatología no se controla con tratamiento médico. La cirugía permite la obtención de material para llegar al diagnóstico histológico definitivo y caracterización molecular del tumor. A su vez es la primera maniobra terapéutica que, en la mayoría de los pacientes, además de mejorar la sintomatología, mejora el pronóstico. El manejo radioterápico de los OD es parecido al de los astrocitomas de bajo grado: la radioterapia puede diferirse en los pacientes con buena situación clínica, siempre que se haga un seguimiento cuidadoso. Se reservará la radioterapia para lesiones no quirúrgicas sintomáticas, o en caso de resecciones incompletas. La quimioterapia con PCV o temozolomida consigue un 30-70% de respuestas radiológicas y una mediana de tiempo a la progresión de 2-3 años; sin embargo se desconoce todavía si la quimioterapia previa a la radioterapia es superior a la radioterapia exclusiva en este tipo de tumores. Usada de forma adyuvante tras la radioterapia, la quimioterapia ha demostrado un aumento de la supervivencia libre de progresión, pero no de la supervivencia global.
INTRODUCCIÓN
El oligodendroglioma (OD), un glioma grado II según la clasificación de la OMS 2007 (Louis et al; 2007), es un tumor poco frecuente, infiltrante, difuso, bien diferenciado, de localización habitual en la sustancia blanca de los hemisferios cerebrales, y con una mayor sensibilidad al tratamiento y mejor pronóstico que otros gliomas. Los OD representan entre el 5 y el 20% de todos los tumores gliales, y aparecen en adultos, con un pico de incidencia entre los 35 y los 45 años. En Europa se diagnostican en torno a 1500 nuevos casos anuales. La supervivencia global de estos tumores en el periodo 1990-1994 fue de 80% a un año y de 51% a 5 años (Berrino et al; 2003).
NEUROIMAGEN
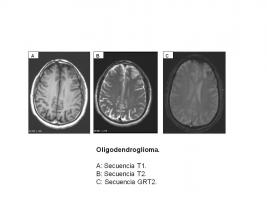
La mayoría de los OD aparecen en localización supratentorial, sobre todo en el lóbulo frontal. En RM son lesiones focales bien delimitadas de sustancia blanca que pueden afectar al córtex y leptomeninges adyacentes, iso o hipointensas en T1 y con focos hiperintensos en T2, con captación moderada de contraste, típicamente parcheada. Ocasionalmente aparecen mal delimitados, con aspecto infiltrativo. Es muy frecuente la calcificación (70-90%), mejor valorada con TC que con RM. En ocasiones hay degeneración quística, pero la hemorragia y el edema son poco frecuentes. Si aparece en localización intraventricular (poco frecuente), es indistinguible por imagen del neurocitoma central. Al igual que otros gliomas de bajo grado son tumores que permanecen localizados en el sistema nervioso central y no es necesario un estudio de extensión extracraneal como parte de la estadificación [Oligodendroglioma.jpg].
HISTOPATOLOGÍA
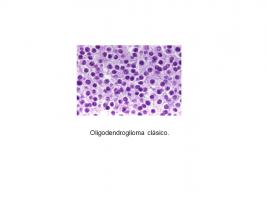
Histológicamente son gliomas infiltrativos, con celularidad moderada, monomórfica, con núcleos redondos rodeados de un halo que les da un típico aspecto de huevo frito. Puede haber microcalcificaciones y una densa red capilar. En el córtex, las células tumorales tienden a formar estructuras secundarias (satelitosis). [Histopatología Oligodendroglioma.jpg]
BIOLOGÍA MOLECULAR
La alteración genética característica de los OD es la co-delección 1p/19q, genotipo que confiere una mayor sensibilidad a los tratamientos quimio y radioterápicos y que a su vez se ha relacionado con un curso clínico mas indolente (Van den Bent et al; 2003). La incidencia de alguna de las dos delecciones (1p o 19q) en OD se sitúa en torno al 75%, y la co-delección aparece entre el 60 y el 70% de los casos. En ODs con genotipo 1p/19q se ha descrito ausencia de mutaciones de TP53, amplificación de EGFR, pérdida de 10q, o mutaciones en PTEN (alteraciones genéticas frecuentes en los astrocitomas).
PRONÓSTICO
Se han publicado diversos estudios para identificar factores que pueden influir en el pronóstico de estos tumores. La histología es el factor más obvio. En una serie de 167 pacientes, Leighton et al. encontraron una mayor supervivencia libre de progresión (SLP) y supervivencia global (SG) en los pacientes con oligodendroglioma o con oligoastrocitoma que en los que presentaban un astrocitoma puro (SLP: 5,6 frente a 4,4 años, p=0,054. SG: 13 años frente a 7,5 años, p=0,003). La edad < 40 años, las crisis comiciales como síntoma de presentación, y el índice de Karnofsky (KPS) >70 resultaron factores de buen pronóstico en el análisis uni y multivariante, así como la cirugía radical o con resto tumoral mínimo (Leighton et al; 1997).
En los oligodendrogliomas de bajo grado, la co-delección de 1p y 19q se asocia a mejor pronóstico con independencia del tratamiento (Walter et al; 2005). La presencia de metilación en el promotor del gen de la O6-metilguanin DNA metil-transferasa (MGMT) ha demostrado ser un factor predictivo de respuesta al tratamiento con temozolomida (Everhard et al; 2006) y en OD se ha relacionado con la presencia de co-delección 1p/19q (Levin et al; 2006).
TRATAMIENTO INICIAL
En cuanto al tratamiento del OD hay que tener en cuenta que hasta hace muy poco los ensayos clínicos incluían astrocitomas grado II, oligodendrogliomas grado II y oligoastrocitomas como gliomas de bajo grado, y la mayoría de los datos disponibles provienen de resultados del análisis por subgrupos de dichos ensayos. Las opciones terapéuticas que se plantean son: observación, cirugía, radioterapia y tratamiento quimioterápico.
Observación
La observación estricta, con controles radiológicos (RM) cada 3 meses el primer año y posteriormente cada 6 meses en años sucesivos, se recomienda en aquellos pacientes asintomáticos o mínimamente sintomáticos, e incluso en aquellos con crisis epilépticas al diagnostico pero bien controladas con tratamiento médico (Rect. et al; 1992). Esta opción terapéutica está contraindicada en aquellos pacientes cuya sintomatología no se controla con tratamiento médico.
Cirugía
La cirugía en los OD permite la obtención de material para llegar al diagnóstico histológico definitivo y caracterización molecular del tumor. A su vez es la primera maniobra terapéutica que, en la mayoría de los pacientes, además de mejorar la sintomatología, mejora el pronóstico. Varios estudios retrospectivos han demostrado que la extensión de la resección quirúrgica está relacionada con la supervivencia de los pacientes con OD (Sanai et al; 2008), y en estudios multivariantes la resección macroscópicamente completa aparece como el factor pronóstico más importante (Smith et al; 2008).
Radioterapia (RT)
El manejo radioterápico de los OD es parecido al de los astrocitomas de bajo grado: la radioterapia puede diferirse en los pacientes con buena situación clínica, siempre que se haga un seguimiento cuidadoso (Van den Bent et al; 2005). Se reservará la RT para lesiones no quirúrgicas sintomáticas, o en caso de resecciones incompletas. Se administran 50-54Gy con un fraccionamiento convencional de 2 Gy por sesión, considerando el volumen diana como el lecho tumoral prequirúrgico más 1-2 cm de seguridad (Shaw et al; 2002).
TRATAMIENTO DE LA PROGRESIÓN
En el momento de la progresión la quimioterapia según esquema PCV se estableció a finales de los 90 como tratamiento estándar en OD. Los estudios publicados por Van den Bent et al. (Van den Bent et al; 1998), y Soffietti et al. (Soffietti et al; 1998), objetivaron una tasa de respuestas cercana al 60% y una mediana de tiempo a la progresión entre 12 y 18 meses, ocasionalmente mucho mas prolongada (>24 meses). Dada la conocida toxicidad (sobre todo hematológica y gastro-intestinal) de la combinación, en los últimos años se han realizado varios estudios fase II con temozolomida en OD recurrentes (Brandes et al; 2006, Van den Bent et al; 2003). Las tasas de respuestas varían entre el 46% y el 55%, con una supervivencia libre de progresión a los 12 meses entre el 40% y el 50%, y una mediana de supervivencia libre de progresión entre 10 y 12 meses. Estos resultados son similares a los obtenidos con PCV, pero con menor toxicidad. Por este motivo, a pesar de que no disponemos de ningún estudio randomizado que compare directamente los dos esquemas de tratamiento, la temozolomida en monoterapia es el fármaco de eleccion para el tratamiento del OD recurrente.
En el tratamiento de progresiones sucesivas se recomienda la temozolomida en aquellos casos en los que la primera progresión se haya tratado con PCV, y la combinación irinotecan-bevacizumab en pacientes pediátricos multitratados se ha utilizado con resultados muy positivos (Packer et al; 2009). Actualmente la combinación de mesilato de imatinib e hidroxiurea está siendo estudiada en un ensayo fase II como tratamiento de gliomas de bajo grado recurrentes.
BIBLIOGRAFÍA
Berrino F, Capocaccia R, Coleman MP, et al. (2003). Survival of cancer patients in Europe: the EUROCARE-3 study. Ann Oncol. 14(Suppl 5).
- 58155 lecturas