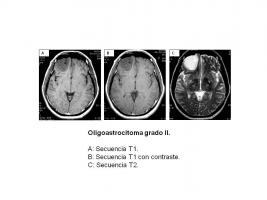
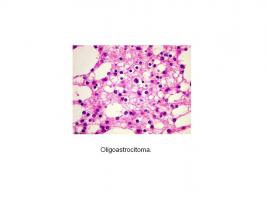
Oligoastrocitoma (grado II)
INTRODUCCIÓN
Los oligoastrocitomas o gliomas mixtos de bajo grado (OA) pertenecen al grupo de los gliomas grado II según la clasificación de la OMS, y se caracterizan por presentar características histopatológicas y moleculares propias tanto de los astrocitomas difusos como de los oligodendrogliomas de bajo grado. Comparten a su vez con otros gliomas de bajo grado su característico curso indolente y su potencial malignización.
NEUROIMAGEN
Por imagen es indistinguible del oligodendroglioma (OD). En RM son lesiones focales bien delimitadas de sustancia blanca que pueden afectar al córtex y leptomeninges adyacentes, iso o hipointensas en T1 y con focos hiperintensos en T2, con captación moderada de contraste típicamente parcheada. Ocasionalmente aparecen mal delimitados, de aspecto infiltrativo [Oligoastrocitoma.jpg].
HISTOPATOLOGÍA Y BIOLOGÍA MOLECULAR
Histológicamente, los OA presentan una celularidad moderada con escasas o nulas mitosis. Puede haber microcalcificaciones y degeneración microquística. En este tumor se distinguen células astrocitarias y células oligodendrogliales, que pueden estar en áreas claramente separadas (forma bifásica o compacta) o entremezcladas (forma difusa), que es lo más frecuente [Histopatología oligoastrocitoma.jpg].
Desde el punto de vista molecular destaca la presencia de mutaciones de la isocitrato dehidrogenasa 1 (IDH1) entre el 50% y el 83% de los OA, mutación descrita como evento temprano en la tumorogenesis (Yan et al; 2009). En estos tumores podemos encontrar tanto mutaciones en el gen TP53 como la co-delección 1p/19q característica de los oligodendrogliomas, pero no ambas alteraciones en el mismo tumor, dado que son mutuamente excluyentes.
PRONÓSTICO
Se han publicado diversos estudios para identificar factores que pueden influir en el pronóstico de estos tumores. La histología es el factor más obvio. En una serie de 167 pacientes, Leighton et al. encontraron una mayor supervivencia libre de progresión (SLP) y supervivencia global (SG) en los pacientes con oligodendroglioma o con oligoastrocitoma que en los que presentaban un astrocitoma puro (SLP: 5,6 frente a 4,4 años, p=0,054; SG:13 frente a 7,5 años, p=0,003). La edad < 40 años, las convulsiones como síntoma de presentación, y el índice de Karnofsky (KPS) >70 resultaron factores de buen pronóstico en el análisis uni y multivariante, así como la cirugía radical o con resto tumoral mínimo (Leighton et al; 1997). Varios marcadores moleculares han sido estudiados como factores pronósticos en los gliomas de bajo grado. En OA, al igual que en los OD, la pérdida de heterocigosidad en los cromosomas 1p y 19q se ha relacionado con un mejor pronóstico (Ohgaki et al; 2005). La presencia de metilación en el promotor del gen de la O6-metilguanin DNA metil-transferasa (MGMT) ha demostrado ser un factor predictivo de respuesta al tratamiento con temozolomida (Everhard et al; 2006).
TRATAMIENTO
En cuanto al tratamiento del OA hay que tener en cuenta que hasta hace muy poco los ensayos clínicos incluían astrocitomas difusos, oligodendrogliomas grado II y oligoastrocitomas mixtos como gliomas de bajo grado, y la mayoría de los datos disponibles provienen de resultados del análisis por subgrupos de dichos ensayos. Las opciones terapéuticas que se plantean son: observación, cirugía, radioterapia y quimioterapia.
Observación
La observación estricta, con controles radiológicos (RM) cada 3 meses el primer año y posteriormente cada 6 meses en años sucesivos, se recomienda en aquellos pacientes asintomáticos o mínimamente sintomáticos, e incluso en aquellos con crisis epilépticas al diagnostico, pero bien controladas con tratamiento médico (Rect. et al; 1992). Esta opción terapéutica está contraindicada en aquellos pacientes cuya sintomatología no se controla con tratamiento médico.
Cirugía
La cirugía en los OA permite la obtención de material para llegar al diagnóstico definitivo y caracterización molecular del tumor, y es a su vez la primera maniobra terapéutica que, en la mayoría de los pacientes, además de mejorar la sintomatología, mejora el pronóstico. Varios estudios retrospectivos han demostrado que la extensión de la resección quirúrgica está relacionada con la supervivencia de los pacientes con OD (Sanai et al; 2008), y en estudios multivariantes la resección macroscópicamente completa aparece como el factor pronostico más importante (Smith et al; 2008)
Radioterapia (RT)
El manejo radioterápico de los OA es parecido al de los astrocitomas y oligodendrogliomas de bajo grado: la RT puede diferirse en los pacientes con buena situación clínica, siempre que se haga un seguimiento cuidadoso (Van den Bent et al; 2006). Se reservará la RT para lesiones no quirúrgicas sintomáticas, o en caso de resecciones incompletas. Se administran 50-54 Gy con un fraccionamiento convencional de 2 Gy por sesión, considerando el volumen diana como el lecho tumoral prequirúrgico más 1-2 cm de seguridad (Shaw et al; 2002).
Tratamiento de las recurrencias
BIBLIOGRAFÍA
Brandes AA, Tosoni A, Cavallo g, et al. (2006). Correlations between O6-methylguanine DNA methyltransferase promoter methylation status, 1p and 19q delections, and response to temozolomide in anaplastic and recurrent oligodendroglioma: a prospective GICNO study. J Clin Oncol 2006; 24: 4746-4753.
- 30345 lecturas