RESUMEN
Los oligodendrogliomas anaplásicos (ODA) son gliomas infiltrantes de grado III de la OMS. Son tumores poco frecuentes, con una incidencia de 0,07 a 0,18 por 100.000 habitantes y año. Representan el 5-20% de todos los tumores gliales. Se presentan en adultos con un pico de incidencia entre los 45-50 años. Su localización preferente son los lóbulos frontal y temporal. A diferencia de los OD de bajo grado que suelen presentar crisis comiciales como síntoma principal, los ODA con frecuencia aparecen con déficit motores, déficit cognitivos e incluso síntomas de aumento de presión intracraneal. Su mediana de supervivencia global está en torno a los 4.5 años y la tasa de supervivencia a 5 años cercana al 40%.
En las pruebas de neuroimagen, con frecuencia presentan calcificaciones visibles en la TC. Su imagen en RM con gadolinio es heterogénea con necrosis, degeneración quística, y hemorragias intratumorales. En ocasiones presentan una imagen en anillo con necrosis central similar a la del GB, que se relaciona con un peor pronóstico. Los ODA se encuentran constituidos por células neoplásicas de características similares a las de la oligodendroglía y muestran rasgos histológicos de malignidad como marcada atipia nuclear, celularidad aumentada, elevada actividad mitótica, proliferación microvascular y necrosis. Aunque morfológicamente indistinguibles, se reconocen dos subtipos de ODA: aquellos que presentan delección del brazo corto de cromosoma 1 (1p) y del brazo largo del cromosoma 19 (19q), que cursan con un mejor pronóstico y una mejor respuesta al tratamiento, y los que no muestran delección de 1p/19q. El tratamiento clásico de estos tumores incluye resección quirúrgica y radioterapia. La adición de quimioterapia a este régimen de tratamiento ha demostrado aumento de la supervivencia libre de progresión, pero no de la supervivencia global.
INTRODUCCIÓN
Los oligodendrogliomas anaplásicos (ODA), por definición gliomas infiltrantes de grado III, tienen una incidencia de 0,07 a 0,18 por 100.000 habitantes y año. Representan el 5-20% de todos los tumores de células gliales. Se presentan en adultos, con un pico de incidencia entre los 45-50 años (Berrino et al; 2003). Su localización preferente es en el lóbulo frontal, seguido del lóbulo temporal. Pueden proceder de un oligodendroglioma de grado inferior (la mediana de tiempo de progresión de un tumor grado II a un grado III es de 7 años). La mediana de supervivencia global descrita en pacientes con ODA puros está en torno a los 4.5 años y la tasa de supervivencia a 5 años cercana al 40% (Shaw et al; 1997).
Generalmente se localizan en la sustancia blanca y tienen gran afinidad por los lóbulos frontales, aunque pueden encontrarse en cualquier localización (incluso infratentorial o en la médula espinal). Al igual que otros gliomas de bajo grado, son tumores que habitualmente permanecen localizados en el sistema nervioso central. Se han descrito metástasis extracraneales (óseas) y diseminación leptomeníngea, pero son casos muy raros y generalmente aparecen con tumores muy avanzados y recurrentes.
MANIFESTACIONES CLÍNICAS
Clínicamente los síntomas de presentación suelen ser inespecíficos y dependen de la localización tumoral. A diferencia de los OD de bajo grado que suelen presentar crisis comiciales como síntoma principal, los ODA con frecuencia aparecen con déficit motores, déficit cognitivos e incluso síntomas de aumento de presión intracraneal.
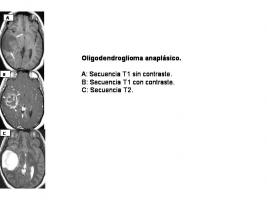
NEUROIMAGEN Respecto al diagnostico por imagen, con frecuencia presentan calcificaciones visibles en la TC. Su imagen en RM con gadolinio es heterogénea [Oligodendroglioma anaplásico.jpg] con necrosis, degeneración quística, hemorragias intratumorales y las calcificaciones mencionadas (visibles mejor en la TC).
En ocasiones presentan una imagen en anillo con necrosis central similar a la del GB que se relaciona con un peor pronóstico (Tortosa et al; 2003), lo cual contrasta con el hecho de que la necrosis histológica en los tumores con morfología clásica de ODA no empeora la supervivencia (Millar et al; 2006). La morfología de ODA puro se asocia significativamente a las pérdidas alélicas de los cromosomas 1p y 19q (Giannini et al; 2008).
HISTOPATOLOGÍA Y BIOLOGÍA MOLECULAR
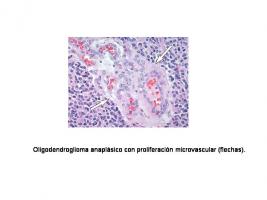
Los ODA se encuentran constituidos por células neoplásicas de características similares a las de la oligodendroglía y, bajo el microscopio, muestran rasgos histológicos de malignidad como marcada atipia nuclear, celularidad aumentada, elevada actividad mitótica, proliferación microvascular y necrosis [Histopatología oligodendroglioma anaplásico.jpg].
Aunque morfológicamente indistinguibles, se reconocen dos subtipos de ODA: aquellos que presentan delección del brazo corto de cromosoma 1 (1p) y del brazo largo del cromosoma 19 (19q), que cursan con un mejor pronóstico y una mejor respuesta al tratamiento y que representan aproximadamente el 65% de los ODA, y los que no muestran delección de 1p/19q (Van den Bent; 2007). A lo largo de los años el tumor va adquiriendo otras mutaciones y alteraciones genéticas en su evolución como delecciones en el gen CDKN2A (p16) que aparece entre el 33% y el 50% de los casos, o delecciones en el cromosoma 10 (hasta en un 25% de los ODA).
PRONÓSTICO
La edad de presentación <40 años, un buen estado general y la localización frontal son factores clínicos favorables. Desde el punto de vista molecular, la presencia de co-delección 1p/19q se ha confirmado como marcador de buen pronóstico en varios ensayos clínicos, entre ellos en el RTOG 9402 (Cairncross et al; 2006) y en el EORTC 26951 (Van den Bent et al; 2006).
TRATAMIENTO INICIAL
En cuanto al tratamiento del ODA hay que tener en cuenta que hasta hace muy poco los ensayos incluían oligodendrogliomas grado III, oligoastrocitomas grado III, y astrocitomas grado III y grado IV como gliomas malignos. La mayoría de los datos disponibles provienen de resultados del análisis por subgrupos de dichos ensayos, y por lo tanto son resultados poco consistentes.
Cirugía.
El papel de la cirugía es crucial para obtener el diagnóstico histológico, producir una descompresión inmediata del cerebro y mejorar el pronóstico de los pacientes. En su planteamiento debe considerarse el objetivo principal que es el de lograr la máxima resección manteniendo al mismo tiempo la mejor función neurológica posible para preservar la calidad de vida. La edad del paciente, y su estado general (PS) son factores que han de ser considerados en la selección del tratamiento quirúrgico. La radicalidad de la cirugía ha demostrado ser un factor pronóstico en gliomas en estudios retrospectivos (McGirt et al; 2008). No es posible realizar estudios aleatorizados sobre el valor de la cirugía, dado que algunos tumores seguirían siendo irresecables a pesar de una indicación quirúrgica por aleatorización (la posibilidad de resección depende de la ‘no localización del tumor en áreas elocuentes’). No está claro si la mayor supervivencia de los pacientes resecados es por el factor de radicalidad o porque pueden tolerar mejor el tratamiento oncológico posterior sin deteriorarse. En cualquier caso, la cirugía en un glioma de alto grado, por definición, nunca será radical debido a la naturaleza infiltrante del tumor.
Radioterapia (RT).
El tratamiento radioterápico ha sido la base del tratamiento de los gliomas malignos durante los últimos 25 años. Dos estudios realizados por el Brain Tumor Study Group (BTSG) en 1978 y 1980 demostraron un aumento de la mediana de supervivencia con el tratamiento radioterápico post-quirúrgico en gliomas malignos (grado III y grado IV) de 4 a 8 meses, y un aumento del número de pacientes vivos a los 18 meses del 10% al 15-20% (Walter et al; 1978 y 1980). Tras varios estudios de búsqueda de dosis realizados en los años 80 se definió como tratamiento estándar, para pacientes con un adecuado estado general, la administración de una dosis total de RT de 60 Gy en 30 fracciones tras la cirugía en gliomas de alto grado (Bleehen et al; 1991).
Quimioterapia.
En cuanto al tratamiento posterior, dos estudios, uno europeo de la EORTC y otro americano de la RTOG, aleatorizaron a los pacientes a recibir tratamiento con quimioterapia tipo PCV antes de la RT local (4 ciclos en el estudio RTOG, Cairncross et al; 2006) o después (6 ciclos en el de la EORTC, Van den Bent et al; 2006). En ambos estudios los resultados fueron similares: se obtuvo una mejoría de la supervivencia libre de progresión sin que la supervivencia global se viera afectada en los pacientes que recibieron quimioterapia, pero a expensas de mayor toxicidad. En ambos estudios se confirmó que los pacientes que presentaban pérdida de 1p y 19q tuvieron mejores resultados tanto con quimioterapia como con RT (Giannini et al; 2008). Lo que no puede valorarse es si los pacientes con dicha alteración genética podrían recibir sólo RT, y reservarse la quimioterapia o a la inversa. Por otro lado los pacientes sin pérdida de 1p 19q quizás podrían beneficiarse de un tratamiento como el indicado en el GB, dado su peor pronóstico. La conclusión de ambos estudios es que la quimioterapia tipo PCV adyuvante a la RT (“temprana”) no mejora la supervivencia global comparada con el tratamiento quimioterápico (PCV) administrado en el momento de la progresión. Probablemente la temozolomida (TMZ) adyuvante pueda ser una mejor opción en pacientes con un estado general frágil dado su perfil de toxicidad manejable (aunque solo disponemos de resultados de pequeños estudios fase II en primera línea (Mikkelsen et al;2009, Vogelbaum et al; 2009)). Con el objetivo de resolver dichas cuestiones, se ha iniciado un nuevo ensayo de la EORTC que aleatoriza a los pacientes con pérdidas alélicas de 1p y 19q (protocolo EORTC 26081-22086) en tres brazos: quimioterapia exclusiva con TMZ (sin radioterapia), el esquema de Stupp (quimio-radioterapia) o a radioterapia exclusiva.
TRATAMIENTO DE LAS RECURRENCIAS
En el tratamiento de las recurrencias hay que diferenciar las recurrencias locales, en las que se puede plantear una re-resección quirúrgica, de las recurrencias irresecables.
En los casos de pacientes que presentan una recurrencia local en los bordes del tumor resecado previamente, podemos plantearnos un tratamiento localizado: cirugía, cirugía con aplicación de polímeros de BCNU (Brem et al; 1995) o re-irradiación local en pacientes seleccionados (Combs et al; 2008).
En el tratamiento de las recurrencias irresecables, la quimioterapia según esquema PCV se estableció a finales de los 90 como tratamiento estándar tras la demostración de la excelente quimiosensibilidad de los ODA en los estudios publicados por Cairncross y McDonald (Cairncross et al; 1994). Objetivaron que aproximadamente 2/3 de los pacientes con ODA recurrente tras RT previa obtenía un respuesta completa o parcial con la quimioterapia PCV, y una mediana de tiempo a la progresión entre 12 y 18 meses, ocasionalmente mucho mas prolongada (>24 meses). Dada la conocida toxicidad (sobre todo hematológica y gastro-intestinal) de la combinación, en los últimos años se han realizado varios estudios fase II con temozolomida (Brande et al; 2006, Van den Bent et al; 2003). Las tasas de respuestas varían entre el 46% y el 55%, con una supervivencia libre de progresión a 12 meses entre el 40% y el 50%, y una mediana de supervivencia libre de progresión entre 10 y 12 meses. Estos resultados son similares a los obtenidos con PCV pero con menor toxicidad secundaria. Por este motivo, a pesar de que no disponemos de ningún estudio randomizado que compare directamente los dos esquemas de tratamiento, la temozolomida en monoterapia es el fármaco de elección para el tratamiento del ODA recurrente.
En el tratamiento de progresiones sucesivas se recomienda la temozolomida en aquellos casos en los que la primera progresión se haya tratado con PCV (o hayan recibido PCV adyuvante) (Chinot et al; 2001). La combinación irinotecan-bevacizumab en pacientes pediátricos multitratados se ha utilizado con resultados muy positivos (Packer et al; 2009).
BIBLIOGRAFÍA
Berrino F, Capocaccia R, Coleman MP, et al. (2003). Survival of cancer patients in Europe: the EUROCARE-3 study. Ann Oncol. 14(Suppl 5).
Bleehen NM, Stenning SP. A Medical Research Council trial of two radiotherapy doses in the treatment of grades 3 and 4 astrocytoma. (1991). The Medical Research Council Party. Br J Cancer. 64:769-774.
Brandes AA, Tosoni A, Cavallo g, et al. (2006). Correlations between O6-methylguanine DNA methyltransferase promoter methylation status, 1p and 19q delections, and response to temozolomide in anaplastic and recurrent oligodendroglioma: a prospective GICNO study. J Clin Oncol. 24: 4746-4753.
Brem H, Piantadosi S, Burger PC, Walker M, Selker R, Vick NA, Black K, Sisti M, Brem S, Mohr G, et al. (1995). Placebo-controlled trial of safety and efficacy of intraoperative controlled delivery by biodegradable polymers of chemotherapy for recurrent gliomas. The Polymer-brain Tumor Treatment Group. Lancet. 345: 1008-1012.
Cairncross G, Macdonald D, Ludwin S, Lee D, Cascino T, Buckner J, Fulton D, Dropcho E, Stewart D, Schold C Jr, et al. (1994). Chemotherapy for anaplastic oligodendroglioma. National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol. 12: 2013-2021.
Cairncross G, Berkey B, Shaw E, Jenkins R, Scheithauer B, Brachman D, Buckner J, Fink K, Souhami L, Laperierre N, Mehta M, Curran W. (2006). Phase III trial of chemotherapy plus radiotherapy compared with radiotherapy alone for pure and mixed anaplastic oligodendroglioma: Intergroup Radiation Therapy Oncology Group Trial 9402. J Clin Oncol. 24: 2707-2714.
Combs SE, Bischof M, Welzel T et al. (2008). Radiochemotherapy with temozolomide as re-irradiation using high precision fractionated stereotactic radiotherapy (FSRT) in patients with recurrent gliomas. J Neurooncol. 89: 205-210.
Chinot OL, Honore S, Dufour H, Barrie M, Figarella-Branger D, Muracciole X, Braguer D, Martin PM, Grisoli F. (2001). Safety and efficacy of temozolomide in patients with recurrent anaplastic oligodendrogliomas after standard radiotherapy and chemotherapy. J Clin Oncol. 19: 2449-2455.
Giannini C, Burger PC, Berkey BA, et al. (2003). Anaplastic Oligodendroglial Tumors: Refining the Correlation among Histopathology, 1p 19q Deletion and Clinical Outcome in Intergroup Radiation Therapy Oncology Group Trial 9402. Brain Pathol. 18: 360-369.
Giannini C, Burger PC, Berkey BA, et al. (2008). Anaplastic Oligodendroglial Tumors: Refining the Correlation among Histopathology, 1p 19q Deletion and Clinical Outcome in Intergroup Radiation Therapy Oncology Group Trial 9402. Brain Pathol. 18: 360-369.
McGirt MJ, Chaichana KL, Gathinji M, et al. (2008). Independent association of extent of resection with survival in patients with malignant brain astrocytoma. J Neurosur. 63: 700-707.
Mikkelsen T, Doyle T, Anderson J, Margolis J, Paleologos N, Gutierrez J, Croteau D, Hasselbach L, Avedissian R, Schultz L. (2009). Temozolomide single-agent chemotherapy for newly diagnosed anaplastic oligodendroglioma. J Neurooncol. 92: 57-63.
Miller CR, Dunham CP, Scheithauer BW, Perry A. (2006). Significance of necrosis in grading of oligodendroglial neoplasms: a clinicopathologic and genetic study of newly diagnosed high-grade gliomas. J Clin Oncol. 24: 5419-5426.
Packer RJ, Jakacki R, Horn M, Rood B, Vezina G et al. (2009). Objective response of multiply recurrent low-grade gliomas to bevacizumab and irinotecan. Pediatr Blood Cancer. 52: 791-795.
Shaw EG, Scheithauer BW, O’Fallon JR. (1997). Supratentorial gliomas: a comparative study by grade and histologic type. J neurooncol. 31: 273-278.
Tortosa A, Vinolas N, Villa S, et al. (2003). Prognostic implication of clinical, radiologic, and pathologic features in patients with anaplastic gliomas. Cancer. 97: 1063-1071.
Van der Bent MJ, Taphoorn MJ, Brandes AA, et al. (2003). Phase II study of first line chemotherapy with temozolomide in recurrent oligodendroglial tumors: the European Organization for Research and Treatment of Cancer Brain Tumor Group Study 26971. J Clin Oncol. 21: 2525-2528.
Van den Bent MJ, Carpentier AF, Brandes AA, Sanson M, Taphoorn MJ, Bernsen HJ, Frenay M, Tijssen CC, Grisold W, Sipos L, Haaxma-Reiche H, Kros JM, van Kouwenhoven MC, Vecht CJ, Allgeier A, Lacombe D, Gorlia T. (2006). Adjuvant procarbazine, lomustine, and vincristine improves progression-free survival but not overall survival in newly diagnosed anaplastic oligodendrogliomas and oligoastrocytomas: a randomized European Organisation for Research and Treatment of Cancer phase III trial. J Clin Oncol. 24: 2715-2722.
Van den Bent MJ. (2007). Anaplastic oligodendroglioma and oligoastrocitoma. Neurol Clin. 25: 1089-1109.
Vogelbaum MA, Berkey B, Peereboom D, Macdonald D, Giannini C, Suh JH, Jenkins R, Herman J, Brown P, Blumenthal DT, Biggs C, Schultz C, Mehta M. (2009). Phase II trial of preirradiation and concurrent temozolomide in patients with newly diagnosed anaplastic oligodendrogliomas and mixed anaplastic oligoastrocytomas: RTOG BR0131. Neuro Oncol. 11: 167-175.
Walker MD, Alexander Jr E, Hunt WE, et al. (1978). Evaluation of BCNU and/or radiotherapy in the treatment of anaplastic gliomas. Acooperative clinical trial. J Neurosurg. 49: 333-343.
Walker MD, Green SB, Byar DP, et al. (1980). Randomized comparisons of radiotherapy and nitrosoureas for the treatment of malignant glioma after surgery. N Engl J Med. 303: 1323-1329.