RESUMEN
Los tumores embrionarios del SNC constituyen un grupo heterogéneo de tumores grado IV de la OMS que proceden de células muy indiferenciadas y que incluye al meduloblastoma (MB), tumores neuroectodérmicos primitivos supratentoriales (SPNET), meduloepitelioma, ependimoblastoma y tumor teratoide/rabdoide atípico (ATRT). Tienen en común su comportamiento agresivo y su capacidad de diseminación en el sistema nervioso, o incluso a otros órganos del cuerpo. A pesar de que su apariencia es a menudo similar bajo el microscopio, sus alteraciones genéticas son distintas y por lo tanto hoy en día se consideran entidades diferenciadas. Tanto los PNET de los hemisferios cerebrales como los MB del cerebelo son más frecuentes en niños, aunque también pueden aparecer en adultos. El tumor teratoide/rabdoide atípico (ATRT) es un tumor embrionario que aparece habitualmente en niños menores de 3 años. Su aparición en adultos es excepcional. Los meduloepiteliomas y ependimoblastomas son tumores muy infrecuentes que aparecen en los primeros años de vida.
Los síntomas dependen de la localización del tumor. En los PNET de los hemisferios cerebrales los síntomas más frecuentes son las crisis epilépticas, cefaleas y déficit motores o sensitivos. En los MB y ATRT, los síntomas más frecuentes son las cefaleas, las náuseas y vómitos, inestabilidad, somnolencia y dificultades de coordinación motora. Los meduloepiteliomas y ependimoblastomas suelen manifestarse con síntomas de hipertensión intracraneal.
El estudio diagnóstico en los tumores embrionarios del SNC debe incluir la realización de RM de todo el neuroeje (cerebro y médula espinal) y punción lumbar con análisis citológico del LCR, salvo que exista contraindicación por riesgo de herniación.
El tratamiento consiste en resección quirúrgica lo más completa posible del tumor, seguida habitualmente de radioterapia craneoespinal, y quimioterapia. En niños muy pequeños se emplea en ocasiones sólo quimioterapia tras la cirugía para evitar o retrasar el uso de radioterapia.
INTRODUCCIÓN
Los tumores embrionarios del sistema nervioso central son un grupo de neoplasias grado IV de la OMS que incluyen al meduloblastoma (MB), tumores neuroectodérmicos primitivos supratentoriales (SPNET), meduloepitelioma, ependimoblastoma y tumor teratoide/rabdoide atípico (ATRT) (Louis et al.; 2007). Constituyen un grupo heterogéneo de tumores que tienen en común su alto grado de agresividad, su tendencia a diseminarse dentro del sistema nervioso, y su baja frecuencia de aparición en adultos. A pesar de que su apariencia es a menudo similar bajo el microscopio, sus alteraciones genético-moleculares son distintas.
El MB es el tumor cerebral maligno más frecuente en la infancia; sin embargo representa sólo el 1% de los tumores primarios cerebrales en adultos. El 70% de los MB ocurren en pacientes menores de 16 años. En la edad adulta aparece también típicamente en las edades más jóvenes (el 80% se diagnostican entre los 21 y los 40 años de edad). A pesar de que clásicamente se ha considerado a los MB como una variedad de PNET de aparición infratentorial, existen evidencias de que MB y PNET supratentoriales son entidades diferentes desde el punto de vista genético-molecular.
Al igual que los MB, los PNET supratentoriales aparecen predominantemente en niños y adolescentes, pero son mucho menos frecuentes (representan aproximadamente el 3% de los tumores cerebrales primarios en este rango de edad). No existe consenso sobre su frecuencia de aparición en adultos, debido a su baja incidencia.
El meduloepitelioma es un tumor infrecuente que suele afectar a niños entre los 6 meses y los 5 años de edad, siendo el 50% diagnosticados antes de los 2 años de edad. Se han descrito casos congénitos.
El ependimoblastoma es un tumor infrecuente que aparece en neonatos y niños pequeños.
El ATRT es un tumor infrecuente que aparece habitualmente en niños menores de 3 años, y su aparición en la edad adulta es excepcional.
MEDULOBLASTOMA (MB)
HISTOGENESIS
La histogénesis de los MB ha generado gran controversia desde la descripción inicial del tumor por Bailey y Cushing en 1925. Las dos teorías más aceptadas en la actualidad son las siguientes (Giangaspero et al.; 2007):
- La primera sugiere que el MB tiene su origen en la capa granulosa externa del cerebelo, que se forma durante la embriogénesis a partir de células indiferenciadas que migran desde el techo del cuarto ventrículo a la superficie del cerebelo fetal. En el embrión de 6 meses, la capa granulosa externa comienza a diferenciarse en diversos tipos celulares que emigran hacia el interior para dar origen a la capa granular interna. La capa granulosa externa termina por quedarse sin células y da origen a la capa molecular o plexiforme. Esta hipótesis se sustenta en: 1) la proliferación de precursores neuronales en la capa granulosa externa está controlada por sonic Hedgehog (un mitógeno secretado por las células de Purkinje, y que forma parte de una de las vías de señalización intracelular de mayor importancia en MB); 2) la existencia de modelos murinos de MB obtenidos a través de la activación de la vía de Hedgehog; y 3) las similitudes en el patrón de expresión génica entre las células de MB y las células de la capa granulosa externa del cerebelo en desarrollo.
- La segunda teoría sugiere que los MB derivan de las células de la matriz germinal subependimaria (células “madre” precursoras, presentes en diversas localizaciones del SNC embrionario, que darán lugar a las células neuronales y gliales durante el desarrollo). Aquí estaría implicada la vía de señalización Wnt/beta-catenina. Según esta teoría, los PNET de localización supratentorial tendrían este mismo origen común con los MB infratentoriales. Sin embargo, esta teoría se ha visto criticada recientemente porque aunque las características histológicas sean muy similares, las alteraciones genéticas de los PNET supratentoriales y de los MB son distintas.
Recientemente, se han propuesto nuevas teorías, como que los MB se pueden originar a través de más de un tipo celular, o que existen otras posibles células progenitoras en otras localizaciones (p.ej., células madres presentes en la sustancia blanca del cerebelo postnatal).
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas más frecuentes son la ataxia y los síntomas de hipertensión intracraneal por obstrucción al flujo de LCR (cefalea, vómitos, alteración del nivel de conciencia).
NEUROIMAGEN
Los MB son habitualmente iso o hipointensos en secuencias T1 e hiperintensos en T2. Es frecuente que presenten aspecto heterogéneo por la presencia de zonas quísticas, vasos sanguíneos, necrosis o calcificaciones. El grado de captación de contraste es muy variable (Meyers et al.; 1992). Al igual que otros tumores hipercelulares, los MB suelen mostrar hiperintensidad de señal en difusión y descenso del ADC.
La mayor parte de los MB pediátricos se localiza en el vermis. La afectación de los hemisferios cerebelosos es más frecuente en los pacientes de mayor edad. Cuando su localización es muy periférica, pueden simular lesiones extraaxiales como meningiomas o schwannomas vestibulares.
HISTOPATOLOGÍA
Los MB están compuestos por células con núcleos hipercromáticos y escaso citoplasma. Son tumores muy celulares, habitualmente con mitosis frecuentes. La neovascularizacion y necrosis son poco comunes. Se han descrito diversas variantes histológicas que incluyen el MB desmoplásico o nodular, el MB con nodularidad extensa, el MB anaplásico, el MB de células grandes, el MB con diferenciación miogénica y el MB con diferenciación melanótica (Giangaspero et al.; 2007).
ESTADIFICACIÓN
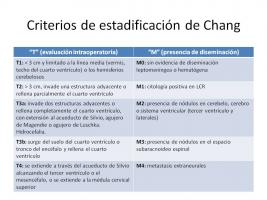
Históricamente, la estadificación de los MB se basaba en la evaluación intraoperatoria del tamaño y localización del tumor, la neuroimagen postoperatoria del cerebro y médula espinal y la citología de LCR (estadíos “T” y “M” de Chang) [Criterios de estadificación de Chang.jpg].
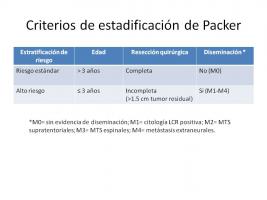
En la actualidad, los criterios de estadificación más empleados son los de Packer (Zeltzer et al.; 1999), que se basan en la edad del paciente, la extensión de la resección y la presencia o no de enfermedad diseminada en base a criterios de neuroimagen y citología de LCR. Según estos criterios se establecen dos categorías de riesgo [Criterios de estadificación de Packer.jpg]:
- Riesgo estándar: incluye a pacientes mayores de 3 años de edad, con resección completa o casi completa (<1.5 cm de enfermedad residual) y ausencia de diseminación (M0).
- Alto riesgo: incluye a pacientes menores de 3 años, con resección subtotal (>1.5 cm de enfermedad residual) o enfermedad metastásica (incluyendo evidencia de diseminación en neuroimagen, citología positiva en LCR, o metástasis extraneurales).
En el momento del diagnóstico inicial existe diseminación a través del LCR a otras localizaciones intracraneales, espinales o ambas en el 10-30% de los pacientes.
La RM es la técnica de neuroimagen de elección para la evaluación de diseminación intracraneal y espinal. De manera ideal, debe realizarse RM de todo el neuroeje antes de la cirugía para evitar falsos positivos por aparición de captación de contraste postquirúrgica. Si no es posible realizarla antes, se aconseja diferir su realización al menos 2 semanas tras cirugía. La RM cerebral postoperatoria para evaluar la existencia de tumor residual debe realizarse en el postoperatorio inmediato (primeras 48-72 horas tras cirugía) o diferirla también al menos 2 semanas.
El significado de una citología positiva en LCR obtenido durante la cirugía o en los primeros 7-10 días tras la misma no está claramente establecido. Sin embargo, su positividad a las 2-3 semanas tras cirugía sí es indicativa de peor pronóstico, por lo que es preferible diferir hasta entonces su obtención.
Las metástasis extraneurales son infrecuentes, por lo que no se recomienda su búsqueda rutinaria en todos los pacientes. Se producen típicamente en hueso y medula ósea.
TRATAMIENTO
-Edad pediátrica.
La cirugía es habitualmente el tratamiento inicial, con el objetivo de confirmar el diagnóstico y lograr la resección tumoral más amplia posible. El tratamiento posterior a cirugía incluye radioterapia de todo el neuroeje (craneoespinal con sobreimpresión de la fosa posterior o del lecho tumoral), habitualmente asociada a quimioterapia. Según la edad del paciente y estadificación del tumor el tratamiento postquirúrgico sufre algunas variaciones:
-MB de riesgo estándar en la edad pediátrica:
El tratamiento tradicional de estos pacientes consistía en radioterapia craneoespinal (54-55 Gy administrado a la fosa posterior y 36 Gy a todo el neuroeje), alcanzándose supervivencias libres de enfermedad del 50-65% a los 5 años. Estudios posteriores han demostrado mejorías en la supervivencia libre de enfermedad hasta el 70-85% a los 5 años con la administración de quimioterapia durante y después de la radioterapia, por lo que en la actualidad la quimioterapia combinada con radioterapia craneoespinal constituye el tratamiento de elección de los pacientes pediátricos con MB de riesgo estándar. Aunque se han utilizado diversos regímenes de quimioterapia, uno de los más utilizados es la combinación de cisplatino, lomustina y vincristina. En la última década se han publicado estudios que respaldan el empleo de quimioterapia en combinación con dosis reducidas de radioterapia craneoespinal (23.4 Gy), con la finalidad de reducir la toxicidad a largo plazo del tratamiento.
-MB de alto riesgo en la edad pediátrica:
El tratamiento estándar comprende la administración de radioterapia craneoespinal y quimioterapia, que ha demostrado tasas de control de la enfermedad de hasta el 50-60% a los 5 años. Los fármacos más empleados son el cisplatino, lomustina, ciclofosfamida, etopósido y vincristina.
-MB en menores de 3 años:
Debido a la mayor toxicidad de la radioterapia craneoespinal sobre el sistema nervioso inmaduro, se han realizado múltiples estudios en estos pacientes para intentar retrasar o evitar su empleo mediante la utilización de quimioterapia intensiva, con resultados variables. Se han publicado cifras de supervivencia libre de enfermedad del 30 al 70%. En estas series, la mayoría de los pacientes con supervivencias prolongadas que habían recibido únicamente quimioterapia eran casos con resección tumoral completa y enfermedad no diseminada. Se han descrito también como factores predictores de buena respuesta a quimioterapia sola en este grupo de edad los hallazgos histológicos de desmoplasia, la expresión elevada de TrkC y la baja expresión de MYCC.
Los pacientes con enfermedad diseminada al diagnóstico presentan peor pronóstico, con supervivencias menores del 30%. No existe consenso sobre cuándo administrar radioterapia y a qué dosis en este grupo de pacientes.
-Edad adulta.
El tratamiento óptimo del MB en la edad adulta no está claramente establecido, sobre todo en lo que se refiere al empleo de quimioterapia en pacientes con MB de riesgo estándar, que no ha sido evaluado en ningún estudio prospectivo.
En el año 2003 se publicaron los resultados del primer estudio prospectivo en 36 pacientes adultos con MB (Brandes et al.; 2003). En dicho estudio, los pacientes de riesgo estándar recibieron únicamente radioterapia craneoespinal (36 Gy a todo el neuroeje y 54.8 Gy al lecho tumoral), mientras que los pacientes de alto riesgo recibieron dos ciclos de quimioterapia neoadyuvante seguida de radioterapia craneoespinal y quimioterapia adyuvante. La supervivencia libre de progresión a los 5 años fue del 76% en los pacientes de riesgo estándar y del 61% en los de alto riesgo. La presencia de enfermedad metastásica marcó una clara diferencia en cuanto a la supervivencia libre de progresión (75% vs. 45% en pacientes con enfermedad M0 vs. M1-4, respectivamente). Con el seguimiento posterior, se observó una supervivencia global del 80% a los 5 años en pacientes de riesgo estándar y del 73% en pacientes de alto riesgo (Brandes et al.; 2007).
Los resultados de un segundo estudio prospectivo en 95 pacientes, publicados recientemente en forma de abstract (Brandes et al.; 2010), mostraron una supervivencia libre de progresión a los 5 años del 68% en pacientes con enfermedad M0 y del 35% en pacientes con enfermedad M1-M3. La supervivencia global a los 5 años fue del 71% y del 47%, respectivamente.
PRONÓSTICO
En la actualidad, el pronóstico y el tratamiento de los MB se basan en criterios clínicos de estratificación de riesgo. Los factores con mayor influencia pronóstica negativa son la existencia de diseminación en el momento del diagnóstico, la menor edad, y posiblemente la presencia de tumor residual tras cirugía.
Sin embargo, es frecuente que MB que poseen el mismo aspecto histológico y que cumplen los mismos criterios clínicos de estratificación, presenten un comportamiento biológico y una respuesta a tratamiento diferentes. Recientemente, se han comenzado a identificar marcadores moleculares con potencial valor pronóstico, como la expresión del receptor de neurotrofina-3 (TrkC) (mejor pronóstico), amplificación de MYCC (resistencia a tratamiento), expresión del receptor ErbB2 (peor supervivencia), pérdida del cromosoma 17p (pobre respuesta a tratamiento, diseminación metastásica, peor supervivencia), expresión nuclear de beta-catenina (mejor pronóstico), y otros. Se han descrito también variantes histopatológicas con influencia pronóstica, en particular las variantes desmoplásica (asociada a mejor pronóstico) y anaplásica (peor pronóstico). Ninguno de estos marcadores genético-moleculares o histológicos ha demostrado valor predictivo en estudios prospectivos hasta el momento, y en consecuencia no se han incluido todavía en los esquemas de estadificación. Sin embargo, es previsible su incorporación junto a los criterios clásicos en un futuro cercano.
TUMORES NEUROECTODÉRMICOS PRIMITIVOS DEL SNC (PNET)
Los tumores neuroectodérmicos primitivos del SNC son un grupo heterogéneo de tumores que ocurren predominantemente en niños y adolescentes, compuestos por células neuroepiteliales indiferenciadas o pobremente diferenciadas. Pueden mostrar rasgos de diferenciación neuronal, astrocítica o ependimaria. Este grupo incluye a los PNET supratentoriales (SPNET), el meduloepitelioma y el ependimoblastoma (McLendon et al.; 2007).
PNET SUPRATENTORIALES (SPNET)
- Localización y Manifestaciones clínicas.
La localización más frecuente son los hemisferios cerebrales, aunque también pueden aparecer en la región supraselar y la médula espinal. Los síntomas más frecuentes en los SPNET de localización hemisférica son las crisis comiciales, alteración del nivel de conciencia, cefalea, vómitos y déficit motor. Los de localización supraselar producen alteraciones visuales y alteraciones endocrinas. En los niños más pequeños puede producirse incremento de la circunferencia craneal.
- Neuroimagen.
Son lesiones iso o hiperdensas en TC craneal, generalmente de aspecto sólido aunque pueden contener áreas quísticas o necróticas. Son frecuentes las calcificaciones (50-70% de los casos). En RM craneal son lesiones hipointensas en T1 y T2, aunque las áreas quísticas y necróticas son hiperintensas en T2. Habitualmente muestran captación de contraste.
- Histopatología.
Los SPNET están compuestos por células neuroepiteliales indiferenciadas o pobremente diferenciadas. Según la clasificación de la OMS, cuando los SPNET muestran diferenciación neuronal reciben el nombre de neuroblastomas, y si también se observan células ganglionares, ganglioneuroblastomas.
- Estadificación.
En los pacientes con SPNET debe realizarse un estudio de estadificación similar al empleado en pacientes con meduloblastoma [Link a 3.2.4.3.1.2.2. Meduloblastoma: Manifestaciones clínicas y diagnóstico]. La diseminación en el momento del diagnóstico es algo menos frecuente que en los MB (10-20%).
- Tratamiento y Pronóstico
-Edad pediátrica.
a) Niños mayores de 3 años.
La resección quirúrgica es el primer paso en el tratamiento, aunque no se ha demostrado que la extensión de la resección tenga influencia pronóstica. El tratamiento posterior suele ser el mismo empleado en niños con MB de alto riesgo, es decir, radioterapia craneoespinal con sobreimpresión del lecho tumoral y quimioterapia. Con estas pautas de tratamiento se han publicado supervivencias globales a los 3 y 5 años del 40%-50%. Los pacientes con enfermedad diseminada en el momento del diagnóstico tienen un pronóstico peor, con supervivencias a los 5 años del 20-30%.
b) Niños menores de 3 años.
El tratamiento es similar al de los pacientes con MB del mismo grupo de edad. La supervivencia a los 5 años con quimioterapia como tratamiento único varía entre el 0%-50%.
-Edad adulta.
Debido a su infrecuente aparición en la edad adulta, no existe un tratamiento claramente establecido. Por lo general se realiza el mismo tratamiento que en la infancia (resección quirúrgica, radioterapia craneoespinal y quimioterapia) (Balafouta et al.; 2002).
MEDULOEPITELIOMA Y EPENDIMOBLASTOMA
Son tumores embrionarios infrecuentes que aparecen típicamente en la edad infantil, para los cuales no existe un tratamiento claramente establecido. El meduloepitelioma presenta hallazgos histológicos que recuerdan a estructuras del tubo neural, mientras que los ependimoblastomas presentan como rasgo característico la presencia de rosetas ependimoblásticas. Ambos presentan tendencia a la diseminación leptomeníngea y un pobre pronóstico, con supervivencias a los 5 años del 0-30%. Debe realizarse la misma estadificación que en los MB y otros PNET [Link a 3.2.4.3.1.2.2. Meduloblastoma: Manifestaciones clínicas y diagnóstico], y el tratamiento es el mismo que en MB de alto riesgo.
TUMOR TERATOIDE / RABDOIDE ATÍPICO (ATRT)
El ATRT es un tumor clínicamente agresivo, grado IV de la OMS, que aparece preferentemente en niños menores de 3 años. Representa aproximadamente el 1-2% de los tumores cerebrales pediátricos, y al menos el 10% de los tumores cerebrales en menores de 3 años (Judkins et al.; 2007). Se ha descrito su aparición en adultos, pero es muy infrecuente. Se describió como entidad clínicamente independiente en base a sus características histológicas y genéticas en 1987 (Rorke et al.; 1996), siendo hasta entonces diagnosticado típicamente de modo erróneo como meduloblastoma, PNET o carcinoma de plexo coroideo. EL ATRT es el primer tumor cerebral primario de la edad pediátrica en el que se ha identificado un gen supresor tumoral, INI1 (también conocido como SMARCB1 o hSNF5), observándose mutación o delección de este gen en aproximadamente el 76% de los ATRT. El ATRT puede aparecer de manera esporádica o en el contexto del síndrome de predisposición familiar a tumores rabdoides.
El ATRT se localiza en la fosa posterior en aproximadamente la mitad de los pacientes, aunque puede aparecer en cualquier localización del sistema nervioso central. Los ATRT infratentoriales pueden aparecer en los hemisferios cerebelosos, ángulo cerebelopontino o tronco del encéfalo. Cuando aparecen en localización supratentorial son más frecuentes en los hemisferios cerebrales, aunque también pueden aparecer en el sistema ventricular, la región supraselar o la glándula pineal (Judkins et al.; 2007). La presentación clínica depende de la localización y tamaño del tumor y de la edad del paciente. Los síntomas más habituales son cefalea, vómitos y alteración del nivel de conciencia, secundarios a hidrocefalia obstructiva. Pueden aparecer también ataxia o regresión psicomotora. Generalmente los síntomas progresan de forma rápida en días o semanas. Aproximadamente el 20% de los pacientes presentan diseminación leptomeníngea del tumor en el neuroeje (cerebro y/o médula espinal) en el momento del diagnóstico inicial. Es posible también la aparición síncrona con un tumor rabdoide renal.
Radiológicamente, los hallazgos son similares e indistinguibles de los presentes en PNET y meduloblastomas. Los ATRT son iso o ligeramente hiperintensos en secuencias FLAIR y muestran típicamente restricción de la difusión y captación variable de contraste. Pueden observarse áreas quísticas o necróticas y signos de diseminación leptomeníngea.
Histológicamente, el ATRT se caracteriza por la presencia de células rabdoides, células pequeñas e indiferenciadas típicas de los PNET y meduloblastomas, y células de tipo mesenquimal o epitelial. El diagnóstico puede ser difícil en base a criterios histopatológicos clásicos. Las técnicas inmunohistoquímicas pueden ayudar al diagnóstico, aunque sus resultados son variables según la composición celular del tumor. El índice de proliferación celular determinado mediante MIB-1 es típicamente muy elevado (50-100%). La tinción inmunohistoquímica para INI1 es una herramienta útil para el diagnóstico diferencial del ATRT con otros tumores cerebrales, en particular los PNET, incluso cuando los hallazgos morfológicos no son los clásicos. En tejido normal y en la mayoría de las neoplasias, INI1 es una proteína que se expresa en el núcleo. En los ATRT se observa pérdida de la expresión nuclear de INI1 en las células tumorales (Judkins et al.; 2007).
Al igual que en MB y PNET, el estudio diagnóstico debe incluir RM cerebral y espinal completa y análisis de LCR, salvo que exista contraindicación. Debe valorarse también la realización de ultrasonografía renal para descartar la presencia de un tumor rabdoide renal síncrono.
No existe un tratamiento estándar establecido para el ATRT. El tratamiento se basa en la edad del paciente y la extensión de la enfermedad (presencia o no de diseminación en el neuroeje). Debido a que se trata de un tumor muy agresivo, suelen emplearse pautas de tratamiento intensivo y multimodal (cirugía, radioterapia, quimioterapia sistémica sin o con trasplante de progenitores hematopoyéticos, y quimioterapia intratecal). En niños muy pequeños suele evitarse o retrasarse la utilización de radioterapia.
La supervivencia media desde el diagnóstico es sólo de aproximadamente 12 meses, aunque se han descrito casos con supervivencia prolongada. La extensión de la enfermedad, la edad del paciente y el empleo de terapia intensiva parecen factores de importancia pronóstica.
BIBLIOGRAFÍA
Balafouta MJ, Kouvaris JR, Miliadou AC, Papacharalampous Xn, et al. (2002). Primitive neuroectodermal tumour in a 60-year-old man: a case report and literature review. British J Radiol. 75: 62-65.
Brandes AA, Ermani M, Amista P, et al. (2003). The treatment of adults with medulloblastoma: a prospective study. Int J Radiat Oncol Biol Phys 57 (3): 755-61.
Brandes AA, Franceschi E, Tosoni A, et al. (2007). Long-term results of a prospective study on the treatment of medulloblastoma in adults. Cancer 110 (9): 2035-41.
Brandes AA, Franceschi E, Tosoni A, et al. (2010). Efficacy of tailored treatment for high- and low-risk medulloblastoma in adults: A large prospective phase II trial. J Clin Oncol. ASCO Annual Meeting Proceedings (Post-Meeting Edition) 28: 2003.
Giangaspero F, Eberhart CG, Haapasalo H, Pietsch T, Wiestler OD, Ellison DW (2007). Medulloblastoma. En: Louis DN, Ohgaki H, Wiestler OD, Cavenee WK (Ed), WHO Classification of Tumours of the Central Nervous System, (pp 132-140). Lyon: IARC.
Judkins AR, Eberhart CG, Wesseling P (2007). Atypical teratoid/rhabdoid tumor. En: Louis DN, Ohgaki H, Wiestler OD, Cavenee WK (Ed), WHO Classification of Tumours of the Central Nervous System, (pp 147-149). Lyon: IARC.
Louis D, Ohgaki H, Wiestler O, et al. (2007). WHO Classification of Tumours of the Central Nervous System. IARC, Lyon.
McLendon RE, Judkins AR, Eberhart CG, Fuller GN, Sarkar C, Ng HK (2007). Central nervous system primitive neuroectodermal tumours. En: Louis DN, Ohgaki H, Wiestler OD, Cavenee WK (Ed), WHO Classification of Tumours of the Central Nervous System, (pp 141-146). Lyon: IARC.
Meyers SP, Kemp SS, Tarr RW (1992). MR Imaging features of meduloblastomas. AJR. 158: 859-865.
National Cancer Institute U. S. National Institutes of Health. Childhood Central Nervous System Atypical Teratoid/Rhabdoid Tumor Treatment (PDQ®). Acceso el 18 de agosto de 2010. http://www.cancer.gov/cancertopics/pdq/treatment/child-CNS-ATRT/healthpr....
Rorke LB, Packer RJ, Biegel JA (1996). Central nervous system atypical teratoid/rhabdoid tumors of infancy and childhood: definition of an entity. J Neurosurg. 85 (1): 56-65.
Zeltzer PM, Boyett JM, Finlay JL, et al. (1999). Metastasis stage, adjuvant treatment, and residual tumor are prognostic factors for medulloblastoma in children: conclusions from the Children's Cancer Group 921 randomized phase III study. J Clin Oncol 17 (3): 832-45.