Complicaciones Neurológicas de la Radioterapia
RESUMEN
La radioterapia, como la mayoría de los tratamientos empleados contra el cáncer, posee una citotoxicidad no específica que afecta tanto a las células tumorales como a las sanas. Cuando el sistema nervioso central o periférico es incluido dentro del campo de irradiación, pueden producirse diversas manifestaciones clínicas que son la consecuencia de los efectos tóxicos de la radioterapia sobre estas estructuras. Con la progresiva utilización de la radioterapia en el tratamiento oncológico se han ido identificando y caracterizando múltiples entidades clínicas. Pese al desarrollo de nuevos regímenes de aplicación, estas complicaciones continúan siendo un problema importante, sobre todo en aquellos pacientes con mayor esperanza de vida. La aparición de complicaciones neurológicas de la radioterapia depende de diversos factores, como el esquema de tratamiento empleado, la edad del paciente, la presencia de edema cerebral previo, la existencia de comorbilidad o tratamientos concomitantes (fundamentalmente quimioterapia simultánea), la susceptibilidad individual a los efectos de la radioterapia y la supervivencia tras el tratamiento.
Los mecanismos por los que la radioterapia induce neurotoxicidad no son bien conocidos, aunque parecen implicar fundamentalmente procesos de daño vascular y desmielinización.
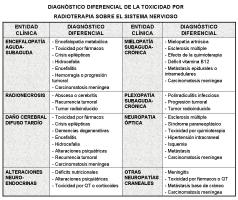
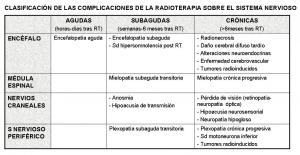
Según su momento de aparición con respecto a la radioterapia, las complicaciones del tratamiento se clasifican en: 1) agudas (en horas o días), 2) subagudas o diferidas precoces (en <6 meses), y 3) crónicas o diferidas tardías (en >6 meses). En general, las complicaciones agudas o subagudas son transitorias o leves, y su curso puede mejorar mediante la administración de diferentes tratamientos (muchos de ellos sin evidencia probada científicamente). Sin embargo, las complicaciones tardías suelen producir cuadros progresivos e irreversibles para los que no existen tratamientos eficaces. La radioterapia puede afectar al sistema nervioso a cualquier nivel, tanto central como periférico [Clasificación de las complicaciones de la radioterapia sobre el sistema nervioso.jpeg]. El diagnóstico diferencial de la toxicidad por radioterapia incluye múltiples entidades, siendo de fundamental importancia la diferenciación con recurrencia tumoral [Diagnóstico diferencial de la toxicidad por radioterapia sobre el sistema nervioso.jpeg].
Pese a la utilización de nuevos esquemas de aplicación de la radioterapia, la aparición de complicaciones neurológicas ha continuado aumentando en los últimos años. Esto puede explicarse por factores como la susceptibilidad individual a la radiación, la ausencia de unos márgenes de seguridad definidos con exactitud y el aumento de la supervivencia de los pacientes oncológicos.
La incidencia de complicaciones neurológicas en relación con la radioterapia depende del esquema de tratamiento empleado (técnica de aplicación, volumen del campo irradiado, dosis total empleada y fraccionamiento de ésta), la edad del paciente, la presencia de edema cerebral previo, la existencia de enfermedades (neoplásicas o no) o tratamientos concomitantes (fundamentalmente quimioterapia simultánea), la susceptibilidad individual a los efectos de la radioterapia y la supervivencia tras el tratamiento (Cross et al; 2003, Chi et al; 2008, De Angelis et al; 2009).
En general, las complicaciones agudas y subagudas de la radioterapia son poco frecuentes, debido en parte a los mejores regímenes de aplicación de la radioterapia y el uso racional de corticoides, mientras que las crónicas son más comunes y graves.
FISIOPATOLOGÍA
Los mecanismos por los que la radioterapia produce los diferentes tipos de daño sobre el sistema nervioso no se conocen con exactitud. En la mayoría de los casos la descripción de los hallazgos anatomo-patológicos ha llevado a la elaboración de diferentes hipótesis patogénicas. Debido a que los principales hallazgos histológicos son la presencia de daño vascular y desmielinización, se ha considerado que las células endoteliales y los oligodendrocitos eran los que sufrían los efectos tóxicos primarios de la radioterapia. Sin embargo, en la actualidad se considera que el mecanismo es más complejo, con un proceso dinámico en el tiempo en el que participan tanto el daño celular directo (sobre células endoteliales y oligodendrocitos, pero también otros elementos celulares) como diferentes interacciones celulares y moleculares consecuencia de la respuesta indirecta de las células a la radioterapia (Wong et al; 2004, Kim et al; 2008, Soussain et al; 2009):
- Endotelio vascular: horas después de la radiación se produce un aumento transitorio de la permeabilidad de la barrera hematoencefálica (BHE) y apoptosis de las células endoteliales mediada por la vía de las esfingomielinasas. Este se considera el mecanismo responsable de la toxicidad aguda por la radioterapia, en la que predomina la existencia de edema cerebral. La perpetuación del daño endotelial a través de mecanismos de apoptosis diferida mediada por el factor de crecimiento del endotelio vascular (VEGF), estrés oxidativo, moléculas de adhesión y citoquinas inflamatorias contribuirían a los efectos tóxicos tardíos de la radioterapia.
- Oligodendrocitos: de forma precoz tras la radiación se produce una desaparición de los progenitores de los oligodendrocitos (mientras que los oligodendrocitos maduros permanecen intactos) por apoptosis mediada a través de la vía p53 (Chow et al; 2000). Esto provoca con el paso de los meses una disminución de la población madura de oligodendrocitos y una pérdida de la mielina en el SNC, con un papel muy importante en la toxicidad crónica de la radioterapia.
- Otras células: muchas otras células participan de forma más o menos directa en la toxicidad de la radioterapia sobre el sistema nervioso. Los astrocitos son los principales responsables de la sobreexpresión del VEGF, molécula clave en la modulación del daño endotelial diferido. Las neuronas, aunque no parece que sufran un daño directo importante tras la radiación, también participan en los procesos responsables del daño tardío de la radioterapia a través de cambios en las sinapsis y procesos de disfunción axonal. Las células microgliales también juegan un papel en la producción de los efectos tóxicos de la radioterapia mediante la generación de radicales libres y procesos de estrés oxidativo. También se ha descrito un daño directo de la radioterapia sobre las células progenitoras neurales y gliales subependimarias. Alteraciones en la neurogénesis en el núcleo dentado se han intentado relacionar con los déficits cognitivos producidos a largo plazo.
APROXIMACIÓN CLÍNICA
En la valoración de los pacientes oncológicos que han recibido radioterapia sobre el sistema nervioso es de suma importancia conocer las complicaciones posibles de ésta y su curso clínico para evitar medidas agresivas, sobre todo en aquellos pacientes con mayor supervivencia. El principal y más amenazador de los diagnósticos diferenciales que se plantean en estos pacientes es la recurrencia o progresión tumoral, aunque hay que tener en cuenta que pueden sufrir otros muchos cuadros de similares características clínicas [Diagnóstico diferencial de la toxicidad por radioterapia.jpeg].
La realización de una RM es obligatoria ante la sospecha de toxicidad de la radioterapia sobre el sistema nervioso, y otras pruebas complementarias pueden ser de utilidad en el diagnóstico. Por ejemplo, las pruebas de medicina nuclear (SPECT y PET) en la sospecha de radionecrosis y el EMG en la sospecha de plexopatía por radiación. En casos seleccionados, debe valorarse siempre la realización de una biopsia quirúrgica que aclare el diagnóstico antes replantearse medidas terapéuticas agresivas.
En general, las complicaciones agudas o subagudas son transitorias o leves, y su curso puede ser mejorado mediante la administración de diferentes tratamientos, muchos de ellos sin evidencia probada científicamente. Sin embargo las complicaciones tardías y la progresión tumoral suelen producir cuadros progresivos que no mejoran con la aplicación de las medidas antes mencionadas. La distinción entre una u otra va a ser de crucial importancia sobre todo en aquellos pacientes jóvenes con una supervivencia elevada.
ENTIDADES CLINICAS
Los efectos adversos de la radioterapia sobre el sistema nervioso pueden ocurrir casi en cualquier momento, desde horas después de la radiación hasta años más tarde. Por ello, una aproximación práctica de las complicaciones de la radioterapia es clasificarlas según su momento de aparición respecto a la radiación. Así, éstas se dividen en agudas (aparecen en los primeros horas-días), subagudas o diferidas precoces (hasta 6 meses después de la radiación) y crónicas o diferidas tardías (a partir de los 6 meses de la radiación).
La radioterapia puede afectar a cualquier parte del sistema nervioso, tanto central como periférico. Además, en ocasiones el daño neurológico se produce de forma indirecta, al afectar a la vascularización o a estructuras neuroendocrinas. Por todo ello, los efectos tóxicos de la radioterapia también se pueden clasificar según el lugar afecto. Probablemente esta última clasificación sea menos útil desde el punto de vista clínico, ya que varios elementos del sistema nervioso pueden verse afectados al mismo tiempo. Sin embargo, la combinación de ambas clasificaciones permite una aproximación práctica sobre las complicaciones de la radioterapia, facilitando su diagnóstico y manejo [Clasificación de las complicaciones de la radioterapia sobre el sistema nervioso.jpeg].
Complicaciones Agudas.
- Fatiga: es la complicación aguda más frecuente y en ocasiones muy incapacitante (Hofman et al; 2007). Aparece días-semanas después del inicio de la radiación y sigue un curso paralelo a la administración de ésta: progresa con posteriores dosis y típicamente mejora los fines de semana cuando se suspende el tratamiento radioterápico. Puede acompañarse de otros síntomas transitorios e inespecíficos como pérdida del gusto y apetito, alopecia y dermatitis. Se deben identificar y tratar procesos concomitantes que colaboren en el cuadro (anemia, alteraciones del sueño, alteraciones metabólicas, dolor, desnutrición). El tratamiento debe incluir medidas no farmacológicas, como ejercicio físico o apoyo psicológico, y fármacos como corticoides o psicoestimulantes (Mustian et al; 2007, Carroll et al; 2007).
Complicaciones Subagudas o Diferidas Precoces.
Suelen desarrollarse desde semanas hasta 6 meses tras la radioterapia. Se cree que son manifestaciones de la desmielinización del sistema nervioso como consecuencia de la pérdida de oligodendrocitos, aunque el daño en la BHE también juega un papel importante. Al contrario que las complicaciones crónicas, suelen ser reversibles y poco frecuentes.
- Encefalopatía subaguda: aparece en los primeros meses tras la radioterapia y engloba diferentes formas clínicas que van desde un empeoramiento radiológico sin repercusión clínica hasta un cuadro de cefalea, estupor, empeoramiento de los déficit neurológicos previos, deterioro cognitivo (fundamentalmente afecta a la atención y memoria reciente y no predice el desarrollo de deterioro cognitivo como complicación crónica) y cambios de personalidad. En ocasiones, si el tronco del encéfalo es incluido en el campo de radiación, pueden aparecer ataxia, nistagmo, disartria o diplopia (Chi et al; 2008, De Angelis et al; 2009, Dropcho; 2010). Las pruebas de neuroimagen pueden ser normales o mostrar generalmente un aumento de la captación de contraste y del edema perilesional.
- Síndrome de somnolencia post radioterapia: cuadro que aparece en torno al mes después del inicio de la radioterapia, sobre todo en niños y cuando ésta se aplica de forma holocraneal. Se caracteriza por la presencia de una somnolencia extrema acompañada en ocasiones por síntomas de hipertensión intracraneal (cefalea, náuseas, vómitos) y fiebre. Las imágenes de RM pueden mostrar hiperintensidades inespecíficas que reflejan la desmielinización subyacente. El cuadro suele resolverse en unas semanas aunque algunos autores proponen el uso de corticoides como tratamiento para evitar su aparición o acelerar la recuperación (Mandell et al; 1989, Uzal et al; 1998).
- Mielopatía subaguda (transitoria): es la forma más frecuente de toxicidad de la médula espinal por radioterapia y aparece tras radiación cráneo-espinal para el tratamiento de tumores primarios del sistema nervioso o más frecuentemente tras radiación incidental de la médula en el tratamiento de linfomas o tumores cráneo-cervicales. Así, en pacientes con enfermedad de Hodgkin que recibieron radioterapia en manto, esta complicación apareció en un 15% de ellos (Word et al; 1980). El cuadro clínico típicamente se caracteriza por la aparición con la flexión cervical de una sensación parestésica eléctrica que desciende a lo largo de la espalda y se extiende en ocasiones por los miembros (signo de Lhermitte). El cuadro suele aparecer 3-6 meses después de la radiación y se resuelve de forma espontánea en unos meses. La RM espinal es normal y debido a que los síntomas son completamente inespecíficos se deben excluir otros diagnósticos alternativos: compresión medular, efecto de la quimioterapia (toxicidad por cisplatino o docetaxel), esclerosis múltiple (que puede ser agravada tras la radioterapia) o déficit de vitamina B12 (Chi et al; 2008). Se considera que es producida por una desmielinización transitoria de los cordones posteriores medulares, aunque no existe confirmación histológica. Su desarrollo no predice la aparición de mielopatía crónica en el futuro, y dado que el cuadro es transitorio y no doloroso no requiere tratamiento.
- Plexopatía subaguda (transitoria): es una complicación poco frecuente que ocurre tras el tratamiento de tumores de mama, pulmón o linfomas en el plexo braquial, o menos frecuentemente de tumores pélvicos en el plexo lumbosacro. Produce un cuadro leve a los meses de iniciarse la radiación que se resuelve de forma espontánea en unas semanas-meses. Suele presentarse como parestesias distales en el pulgar y dedo índice, seguidos de leve debilidad proximal en la afectación del plexo braquial. Puede existir dolor, aunque éste nunca constituye un elemento fundamental en el cuadro. En los miembros inferiores puede existir una afectación bilateral. Su patogenia no se conoce y dada su levedad y carácter transitorio no suele requerir tratamiento (Chi et al; 2008, De Angelis; 2009).
Complicaciones Crónicas o Diferidas Tardías.
Su incidencia está aumentando como consecuencia del incremento de la supervivencia de los pacientes oncológicos. Tienen gran importancia clínica porque, al contrario que las complicaciones agudas o subagudas, suelen ser irreversibles, incapacitantes y responder mal al tratamiento. Se consideran consecuencia de la necrosis isquémica y desmielinización secundaria al daño vascular.
- Radionecrosis: es una de las complicaciones neurológicas de la radioterapia mejor estudiadas. Suele producirse 1-2 años tras el inicio del tratamiento, aunque puede aparecer desde meses hasta décadas tras la radiación. Puede aparecer tras irradiación del sistema nervioso central en el tratamiento de tumores cerebrales o metastáticos, o tras la irradiación incidental en tumores de cabeza y cuello. Su incidencia exacta es muy difícil de calcular debido a que depende de múltiples factores como la dosis total y diaria empleada, el volumen irradiado, la edad del paciente, el uso concomitante de quimioterapia o la presencia de diabetes mellitus (Ruben et al; 2006, Lawrence et al; 2010).
- Mielopatía crónica progresiva: es una complicación poco frecuente pero temida por su curso progresivo e irreversibilidad. Aparece normalmente entre los 6-12 meses tras la radioterapia, aunque puede hacerlo hasta décadas después, y el principal factor de riesgo es la dosis empleada. Se estima que el riesgo de sufrir una mielopatía crónica tras administración de radioterapia con un fraccionamiento convencional (2Gy/d) y una dosis total de 54Gy es <1% (Kirkpatrick et al; 2010). El cuadro clínico se presenta con parestesias distales en los miembros inferiores que van ascendiendo y luego suman debilidad y alteraciones esfinterianas, hasta establecerse un síndrome de Brown-Sequard o una mielopatía transversa con límite superior donde se ha aplicado la radioterapia. El curso es variable, pudiendo estabilizarse o más frecuentemente progresar lentamente hasta establecer un déficit completo (Dropcho; 2010).
- Síndrome de segunda motoneurona o neurona motora inferior: es un cuadro que aparece entre varios meses y muchos años después de la aplicación de radioterapia lumbosacra. Aunque inicialmente se creía que se debía a un daño en las motoneuronas del asta anterior de la médula, en la actualidad se considera que se produce por daño en la porción proximal de las raíces lumbosacras de la cola de caballo (Bowen et al; 1996). Los pacientes desarrollan un cuadro lentamente progresivo de debilidad con flaccidez, fasciculaciones, atrofia y arreflexia más o menos simétrico en los miembros inferiores. Las alteraciones sensitivas o esfinterianas sólo se producen en las fases tardías de la enfermedad (Maier et al; 1969). La RM muestra una captación de contraste de las raíces de la cola de caballo y el líquido cefalorraquídeo tiene una elevación de proteínas. La electromiografía muestra signos de denervación difusos con estudios de conducción nerviosa normales. No existe un tratamiento, aunque los síntomas tienden a estabilizarse a lo largo del curso de la enfermedad.
- Plexopatía crónica progresiva: es una complicación relativamente frecuente que aparece a partir del año después de la radioterapia, aunque puede retrasarse hasta décadas después. La dosis de radiación empleada, la administración de quimioterapia o cirugía axilar, y la edad joven son factores de riesgo para su aparición. El cuadro típico suele afectar a una mujer joven, tratada con radioterapia por un carcinoma de mama con afectación del plexo braquial. El cuadro es lentamente progresivo, iniciándose con parestesias y déficit sensitivos distales para después añadir una debilidad proximal. Puede existir dolor, pero siempre es un síntoma menor. La afectación del plexo lumbosacro es mucho más infrecuente y produce una debilidad asimétrica en ambos miembros inferiores predominando en el territorio L5-S1, siendo los síntomas sensitivos y esfinterianos menos comunes.
- Neuropatías craneales: son complicaciones tardías en su mayoría y poco frecuentes (<1% tras radioterapia convencional) que aparecen en pacientes que han recibido radiación para tratamiento de tumores de cabeza y cuello. El principal factor de riesgo para su aparición es la dosis total y por fracción empleada (Chi et al; 2008, De Angelis; 2009).
La retinopatía por radioterapia provoca una pérdida de visión progresiva e indolora meses-años después de la radiación. Es producida por un mecanismo isquémico secundario a un daño microvascular. Su aparición depende de la dosis empleada, así como de la utilizacion de quimioterapia y la presencia de diabetes concomitante. No existe un tratamiento efectivo.
3. Nervios oculomotores: se ven afectados de manera muy infrecuente por la radiación. Otra complicación es la neuromiotonía ocular (espasmos espontáneos de los músculos oculares como consecuencia de la hiperexcitabilidad de los nervios oculomotores) que produce episodios de diplopia de segundos de duración. Responde bien a fenitoína o carbamazepina.
4. Nervio trigémino: la neuropatía trigeminal es muy rara y principalmente se produce tras tratamiento de lesiones de este nervio con radiocirugía. También puede producirse trismus por fibrosis de los músculos maseteros, en cuyo caso la administración de toxina botulínica puede ser beneficiosa.
5. Nervio cócleo-vestibular: se puede producir una hipoacusia de transmisión subaguda por ocupación del oído medio o una hipoacusia neurosensorial crónica e irreversible, consecuencia del daño directo de la radiación sobre la cóclea. Los síntomas de disfunción vestibular suelen ser menos intensos. La dosis de radiación aplicada, la edad avanzada y la administración de quimioterapia ototóxica (cisplatino) son factores de riesgo para su aparición.
6. Pares bajos: pueden verse afectados por atrapamiento a consecuencia de la fibrosis producida por la radiación. El más frecuentemente afecto, en segundo lugar de las neuropatías craneales tras el nervio óptico, es el hipogloso. Suele producirse una afectación unilateral paucisintomática que se detecta por signos de denervación en la lengua mediante la exploración o en imagen de RM.
- Alteraciones neuroendocrinas: el hipopituitarismo es una complicación frecuente debido fundamentalmente a alteraciones hipotalámicas. Sus manifestaciones dependen de la dosis de radiación administrada, de la hormona deficitaria y de la edad del paciente. La hormona del crecimiento es la más radiosensible (hecho especialmente notable en los pacientes pediátricos, donde provoca cuadros de talla baja si no se produce una adecuada terapia sustitutiva), seguida de las gonadotropinas (alteraciones de la pubertad, infertilidad, hipogonadismo). La hiperprolactinemia debida a afectación de las estructuras hipotalámicas reguladoras es común, aunque suele ser transitoria. La diabetes insípida y las alteraciones de la ACTH y TSH son muy poco frecuentes. Muchas veces estas manifestaciones son pasadas por alto o atribuidas a otras alteraciones sistémicas, produciéndose un retraso en el diagnóstico que puede ser fundamental para conseguir revertir estas anomalías. El tratamiento se realiza mediante terapia sustitutiva de la hormona deficitaria (Fernandez et al; 2009, Darzy et al; 2009).
- Enfermedad cerebrovascular: como ya hemos visto, el daño microvascular es uno de los procesos fundamentales en la mayoría de complicaciones producidas por la radioterapia. Además, la radiación puede producir alteraciones directas sobre vasos de mayor calibre dando lugar a infartos o hemorragias.
2. Vasculopatía cerebral: suele aparecer unos 4 años después de la radiación en niños con neurofibromatosis que han recibido radioterapia para tratamiento de gliomas del nervio óptico. Produce una alteración vascular similar a la enfermedad de moya-moya que se manifiesta en forma de infartos, accidentes isquémicos transitorios, cefalea, crisis epilépticas focales y deterioro cognitivo. La revascularización quirúrgica es una opción para la prevención de nuevos eventos isquémicos (Desai et al; 2006, Chi et al; 2008).
- Tumores radio-inducidos: la radioterapia sirve para tratar tumores, pero también los produce al tratarse de radiaciones ionizantes. Las características definitorias de los tumores secundarios son: su aparición años después del tratamiento, su localización en el campo de aplicación de la radioterapia y su histología diferente de la del tumor inicial. Su incidencia depende de la dosis de radioterapia aplicada y de la edad del paciente, siendo los niños especialmente vulnerables a su aparición. Estos tumores se caracterizan por su agresividad tanto clínica como histológica, mostrando en la mayoría de los casos una localización múltiple y con datos de atipicidad o malignidad en la patología. Esto, unido a las limitadas opciones terapéuticas (debido a su resistencia intrínseca y los tratamientos agresivos aplicados con anterioridad) y su alta tasa de recurrencia les confieren un mal pronóstico (Chi et al; 2008, De Angelis et al; 2009).
En pacientes que han recibido radioterapia sobre los plexos nerviosos, la aparición de tumores del sistema nervioso periférico es una complicación poco frecuente, pero bien conocida. Suelen debutar como una plexopatía muy dolorosa, progresiva, décadas después de la radioterapia. El diagnóstico requiere de exploración quirúrgica con examen histológico y los tipos tumorales más frecuentes son neurofibromas y schwannomas (Zadeh et al; 2007). El tratamiento se basa en la resección quirúrgica agresiva.
Bowen J, Gregory R, Squier M, Donaghy M (1996). The post-irradiation lower motor neuron syndrome: neuronopathy or radiculopathy? Brain. 119: 1429-1439.
- 109621 lecturas