Dolor central postictus.
INTRODUCCIÓN:
A comienzos de siglo, en 1906, Dejerine y Roussy describieron el síndrome talámico, caracterizado por la hiperpatía contralateral a una lesión vascular aguda previa en el tálamo, paradigma del dolor neuropático de origen central. Antes y después, también se ha hecho referencia a este concepto, que actualmente se le denomina dolor central postictus (DCPI) (Henry 2008). El DCPI suele ser conllevar una importante carga para los pacientes, con repercusión en su funcionalidad, afectando a su calidad de vida.
FISIOPATOLOGÍA:
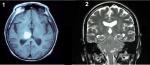
En su fisiopatología se involucran fenómenos de desinhibición, de desajuste de estímulos y de sensitización central. En estudios funcionales con PET y SPECT realizados en los pacientes con DCPI, se ha demostrado hipoperfusión talámica. A pesar de que clásicamente su aparición ha estado vinculada a la afectación del tálamo (núcleo ventral posterolateral), su aparición se observa tras ictus isquémicos y hemorrágicos que se localicen en cualquier punto de las vías sensitivas espinotalamocorticales, y cuya manifestación clínica será contralateral a la lesión anatómica. El síndrome de Wallemberg por ictus bulbar lateral, desencadena la aparición de un DCPI hasta en un 25% de los pacientes, siendo conjuntamente con el ictus talámico, las localizaciones que más frecuentemente están ligadas a este trastorno (ver figura 1).
Figura 1: Hemorragia talámica (1) e ictus bulbar lateral responsable de un síndrome de Wallenberg (2). Ambos localizaciones de ictus se asocian con frecuencia a la aparición de dolor central postictus.
EPIDEMIOLOGÍA:
El DCPI afecta en torno al 8% de los ictus, no parece haber diferencias entre sexos, ni cambios de su incidencia en relación con la edad.
CLÍNICA:
Suele aparecer, por orden de frecuencia, en el brazo, la pierna, el tronco, y la cara, siendo el patrón más común el de dolor hemicorporal. El DCPI aparece por lo general durante los primeros meses tras el ictus, pudiendo o no haber un intervalo tras el ictus, previo a la aparición del dolor, en el que el paciente esté aún asintomático. Con el paso del tiempo la frecuencia de aparición disminuye, pero se han descrito casos de aparición tras más de un año desde el ictus.
El DCPI puede ser espontáneo o evocado. El de tipo espontáneo puede ser continuo o paroxístico, y el evocado puede ser desencadenado por estímulos nociceptivos o no nociceptivos (hiperalgesia, o alodinia respectivamente). La mayoría de los pacientes lo definen como quemante, punzante, opresivo, lacerante o tirante. Se les puede agravar por el movimiento, el tacto, la temperatura, o el estrés (Spencer 2009).
Su presencia puede ser la única secuela, o más frecuentemente ir asociado a alteraciones sensitivas en relación con las modalidades del tacto, el dolor y la temperatura, no alterándose característicamente las sensibilidades vibratoria ni artrocinética. Es muy típica la asociación de combinaciones de hipoestesia e hiperestesia en el área dolorosa. Otros déficits que pueden estar presentes son la presencia de hemiparesia, hemicorea o ataxia.
DIAGNOSTICO:
Esta modalidad de dolor es frecuentemente dificil de diagnosticar, dada la potencial superposición con otro tipo de dolores postictus como los dolores articulares del hombro, o los dolores secundarios a la espasticidad. Los pacientes lo suelen confundir con dolores de otra naturaleza, como de tipo osteomuscular, y aunque puede tener rasgos neuropáticos, estos pueden ser leves, haciendo que su distribución hemicorporal constituya la mayor pista diagnóstica. Esto hace que a veces su filiación tenga que apoyarse en la exclusión de otras patologías como las artritis, las úlceras, la trombosis venosa profunda, o las polineuropatías periféricas. Se han propuesto unos criterios para su diagnóstico (Henriette 2009) (Ver tabla criterios DCPI).
TRATAMIENTO
Muchos tipos de fármacos se han probado en diversos estudios para el tratamiento del DCPI y algunos de ellos han demostrado su eficacia en estudios clase I-II, es el caso de la amitriptilina (75 mg), la lamotrigina (200 mg), y la pregabalina (300-600 mg). También han obtenido resultados positivos la fluvoxamina (125 mg), la clomipramina y la ketamina, esta última para su empleo en pacientes refractarios como rescate en una pauta corta. La carbamacepina se ha mostrado mínimamente efectiva (sólo a las 3 semanas), y los opioides orales como el tramadol pueden tener cierto efecto beneficioso. El uso de gabapentina se puede contemplar en el tratamiento del DCPI, pero no tiene estudios sólidos que avalen su eficacia. Para las situaciones que precisen resolver el dolor a corto plazo, con efectos que duran de 2 a 6 horas, las infusiones intravenosas de lidocaína y propofol se han mostrado efectivas, no así las de morfina. En los pacientes con dolor resistente a fármacos se han obtenido resultados satistactorios con la estimulación magnética transcraneal, la estimulación cerebral profunda, la estimulación calórica vestibular, la estimulación cortical invasiva (Spencer 2009b) y la estimulación medular (Ali 2010).
No hay tratamientos preventivos que hayan demostrado eficacia en disminuir la aparición del DCPI.
BIBLIOGRAFÍA
• Ali, Saitoh Y, Hosomi K, Oshino S, Kishima H, Yoshimine T (2010). Spinal Cord Stimulation for Central Poststroke Pain. Neurosurgery. 2010 Aug 2.
• Henriette Klit, Nanna B Finnerup, Troels S Jensen (2009). Central post-stroke pain: clinical characteristics, pathophysiology, and management Lancet Neurol; 8: 857–68.
• Henry J, Chitra Lalloo BHSc, Kiran Yashpal (2008). Central poststroke pain: An abstruse outcome. Pain Res Manage Vol 13 No 1 January/February.
• Spencer (2009). Central Poststroke Pain: A Review of Pathophysiology and Treatment Anesth Analg;108:1645–57.
- 20579 lecturas