RESUMEN
La cirugía suele ser el primer paso en el tratamiento de los tumores primarios del sistema nervioso. En toda cirugía debe plantearse cuál es el beneficio esperable, que deberá compararse con el riesgo existente para poder indicar la intervención. El beneficio esperable puede incluirse en alguno de estos aspectos: supervivencia, calidad de vida, diagnóstico y obtención de material para investigación.
En determinados tumores (meningiomas, neurinomas, gliomas grado I de la OMS) la cirugía puede ser curativa por sí misma si se extirpa totalmente la lesión. En gliomas de grados II, III y IV, la evidencia acerca del beneficio de la cirugía sobre la supervivencia es limitada, pero hoy en día se acepta que los pacientes con una extirpación amplia tienen mayor supervivencia.
El efecto de la cirugía sobre la calidad de vida puede ser positivo o negativo. El principal perjuicio ocurre si se produce un déficit neurológico; por ello el objetivo debe ser siempre conseguir la máxima extirpación sin provocar déficit. Los índices de morbilidad actuales se han estimado en torno al 13%, mientras que se considera que la mortalidad en craneotomías por tumor debe ser inferior al 2%. Una cirugía sin complicaciones produce un efecto beneficioso en la calidad de vida, al permitir la desaparición o rápida mejoría de los síntomas y la rápida retirada de corticoides.
A pesar de los avances de la neuroimagen, la obtención de tejido tumoral es necesaria para establecer un diagnóstico preciso. Además, cada vez se concede mayor importancia a la obtención de material suficiente y a su correcta conservación con finalidad investigadora.
Los avances de las técnicas quirúrgicas han permitido trabajar en la vecindad del tejido cerebral sano sin dañarlo. Para la planificación quirúrgica correcta, debe determinarse si el tumor está o no en la vecindad de un área elocuente. Actualmente esta planificación puede realizarse mediante RM funcional, PET o Magnetoencefalografía. Estos estudios pueden fusionarse con la RM estructural y llevarse a un navegador quirúrgico. A pesar de la precisión que han alcanzado estas técnicas, si un tumor está a pocos centímetros de un área elocuente, el estándar es realizar un mapeo de la función cortical con monitorización neurofisiológica intraoperatoria. En los últimos años se han incorporado también a la RM las secuencias de tractografía cerebral, con las que es posible visualizar los grandes haces de sustancia blanca y seleccionar el abordaje óptimo de tumores profundos. En algunos centros se cuenta con RM intraoperatoria, que permite comprobar si se ha extirpado todo el tumor y actualizar la información espacial para continuar la cirugía si es preciso. En el glioblastoma, la cirugía guiada por fluorescencia permite ver el tumor en el campo quirúrgico con toda precisión y en tiempo real, con lo que puede aumentar considerablemente el índice de extirpaciones completas.
INTRODUCCIÓN
El tratamiento quirúrgico es el más antiguo empleado para los tumores primarios del sistema nervioso y en general, el primero en aplicarse hoy a la mayoría de los pacientes. Sin embargo el análisis de su utilidad no se acompaña de un nivel de evidencia equivalente al existente para otros tratamientos, por lo que hay muchos puntos controvertidos. Existen pocos aspectos del tratamiento quirúrgico para los que dispongamos de trabajos randomizados en los que fundamentar conclusiones. Entre los motivos para esta escasez de evidencia podemos citar dos como muy relevantes:
1. La cirugía es un tratamiento habitual desde mucho antes de la medicina basada en la evidencia, por lo que existen opiniones preformadas de los médicos y de los pacientes que dificultan o impiden una randomización.
2. El tratamiento quirúrgico en sí mismo es una labor “artesanal”, que no es exactamente igual entre un centro y otro centro, entre un cirujano y otro, ni siquiera de un día a otro, lo cual añade una variabilidad difícilmente controlable.
En los últimos años se ha hecho un esfuerzo por mejorar la calidad de los datos; señalaremos especialmente en esta revisión los aspectos que se acompañan de un mayor nivel de evidencia.
INDICACIONES DE LA CIRUGÍA
En toda cirugía debe plantearse cuál es el beneficio esperable, que deberá compararse con el riesgo existente para poder indicar la intervención. Ese beneficio depende muchísimo del tipo de tumor. En un capítulo general como este, nos referiremos a los tipos más frecuentes de tumores. En todo caso, el beneficio esperable puede incluirse en alguno de estos tres aspectos: Supervivencia, Calidad de vida, Diagnóstico y Obtención de material para investigación.
SUPERVIVENCIA
- Tumores benignos extraaxiales.
En los tumores benignos extraaxiales como meningiomas o neurinomas, la cirugía puede ser curativa por sí misma si se extirpa totalmente la lesión. Existen trabajos con seguimientos prolongados que demuestran que una mayoría de los pacientes con extirpaciones completas tienen supervivencias de muchos años sin recidiva.
Es obvio que en muchos pacientes, el crecimiento del tumor plantea una amenaza real y presente a la función neurológica y a la propia supervivencia del paciente. Sin embargo, existen incógnitas en cuanto a la historia natural de esas lesiones que hacen difícil cuantificar el beneficio de la cirugía en todos los casos. Si para un paciente joven, sintomático, con una lesión grande, la necesidad de la cirugía no se discute, para un paciente mayor con una lesión pequeña asintomática faltan datos precisos para cuantificar riesgos y beneficios. No existen tampoco comparaciones directas entre la cirugía y las alternativas, básicamente las diversas formas de radioterapia, por lo que las recomendaciones se basan en datos indirectos.
En el momento actual, es claro que la cirugía es la mejor opción para las lesiones mayores de 2,5 centímetros, o de 10cc, especialmente si son sintomáticas y en pacientes con expectativa de vida larga. Para lesiones más pequeñas, las probabilidades de control con radiocirugía se incrementan, por lo que según la edad y el riesgo quirúrgico las opciones de tratamiento pueden ser más variadas.
- Tumores intraparenquimatosos.
En los tumores intraparenquimatosos se distinguen situaciones muy diferentes según la estirpe tumoral. Se pueden agrupar en:
1. Tumores bien delimitados, como astrocitomas grado I de la OMS, gangliogliomas, ependimomas, neurocitomas, hemangioblastomas, xantoastrocitomas, subependimomas y algún otro. Estos tumores pueden curarse con cirugía si la extirpación es completa. Para muchos de ellos la alternativa del tratamiento con radiocirugía o radioterapia es una opción más incierta. Se justifica en estos tipos la indicación de una cirugía con intención curativa, siempre sopesando el riesgo de morbilidad con el paciente, al ser lesiones con historia natural larga.
2. Tumores difusos benignos, grado II de la OMS. Típicamente se incluyen aquí astrocitomas y oligodendrogliomas. Este es uno de los grupos donde más se echa de menos información con mayor nivel de evidencia. Hay variables de confusión, por la propia historia natural, que es larga y con mucha variabilidad. Muchos trabajos, pero no todos, encuentran asociación entre cirugías más amplias y mayor supervivencia. En muchos de los trabajos publicados, no se incluye un control de la cantidad de tumor extirpado, ni un análisis multivariante. Los trabajos más recientes (a partir de finales de los 90) tienden a coincidir en que la extirpación amplia de estos tumores se asocia a una mayor supervivencia, al disminuir el crecimiento de la lesión y especialmente el riesgo de transformación a un mayor grado (Smith et al.; 2008). Una revisión de la literatura publicada en 2008 coincide en que los datos son de mala calidad en cuanto a nivel de evidencia, pero apoyan el concepto de que los pacientes en los que se realizó una extirpación amplia tienen supervivencias mayores que los que tienen extirpaciones menores o solo una biopsia (Sanai, Berger; 2008).
3. Gliomas de alto grado. La mayoría de los datos publicados se refieren al glioblastoma (GBM). De los tumores grado III hay menos datos, en general coincidentes. Una revisión de 2008 considera que la evidencia es escasa, pero apoya la idea de que las extirpaciones más amplias se asocian a mayor supervivencia en gliomas de alto grado (Sanai, Berger; 2008). El tema se ha discutido durante muchos años, y la opinión de los expertos ha ido quedando más afianzada a medida que se han publicado más trabajos con la extirpación controlada por RM postoperatoria precoz, en lugar de por la impresión del cirujano. Se ha demostrado que la impresión del neurocirujano no es un indicador fiable de la verdadera extirpación realizada. En el trabajo de Albert (Albert et al.; 1994), los neurocirujanos estimaron un porcentaje de resección completa del 54%, mientras que la RM postquirúrgica precoz mostró un 18%. Se considera aceptado que solo las extirpaciones de un porcentaje grande del tumor proporcionan beneficio en la supervivencia. Este beneficio solo se observó a partir de resecciones superiores al 90% en una revisión clásica sobre más de 400 pacientes, que incluía tratamientos en primera línea y en tumores recurrentes (Lacroix et al.; 2001). Recientemente se ha presentado una serie con más de 500 GBM tratados en primera línea, donde el beneficio empieza a aparecer con resecciones superiores al 78% (Berger, AANS 2010 Meeting). En ambos trabajos el beneficio es máximo con extirpación de todo o casi todo el volumen tumoral (más del 98%). Estos trabajos son retrospectivos, pero recientemente se ha publicado un estudio con evidencia nivel 2b del beneficio de la cirugía en la supervivencia (Stummer et al.; 2008). En este trabajo se randomizó a los pacientes a cirugía con técnica convencional o con utilización de una luz fluorescente tras administración de 5 aminolevulínico (5 ala) (Stummer et al.; 2006). La técnica demostró eficacia para aumentar la extirpación, por lo que equivale a una pseudo randomización de cirugía más extensa. Un ajuste de las cohortes ha permitido obtener evidencia del beneficio, con una mediana de supervivencia de 16,7 meses para la extirpación completa frente a 11,8 para la extirpación incompleta.
El beneficio de la cirugía parece ser sinérgico con el de otros tratamientos. Datos de estudios realizados por la EORTC muestran que el beneficio de temozolomida más radioterapia fue mayor en los pacientes con extirpaciones completas que parciales, y en éstos mayores que en las biopsias (Stupp et al.; 2009). En este estudio, el efecto podría estar infraestimado, puesto que se utilizó la impresión del neurocirujano en vez de la RM postquirúrgica precoz. El grado de extirpación está incluido entre los factores pronóstico recogidos en el calculador de probabilidad de supervivencia de la EORTC (Gorlia et al.; 2008).
A pesar de que se admite el beneficio de la extirpación completa en el pronóstico de los tumores cerebrales primarios, sigue siendo infrecuente la publicación de artículos con control RM de la extirpación del tumor. Los mejores centros han publicado cifras de extirpación completa de 20-30% (Sanai, Berger; 2008). La introducción de técnicas como la cirugía guiada con fluorescencia y la RM intraoperatoria pueden mejorar sustancialmente estas cifras en los próximos años. En el estudio randomizado con el que se aprobó el uso de la fluorescencia en GBM el porcentaje de extirpación completa pasó de un 36% a un 65% de los casos. En experiencia posterior en un solo centro se ha descrito extirpación completa en el 83% de los casos, y una extirpación promedio del 99,5% del volumen (Diez Valle; 2010).
CALIDAD DE VIDA
El efecto de la cirugía sobre la calidad de vida puede ser positivo o negativo. El principal perjuicio sobre la calidad de vida ocurre si se produce un déficit neurológico; por ello el objetivo actual de la cirugía es siempre conseguir la máxima extirpación sin provocar déficit. Los índices de morbilidad actuales se han estimado en torno al 13%, con un 8% de complicaciones neurológicas (Chang et al.; 2003), mientras que se considera que la mortalidad en craneotomías por tumor debe estar por debajo del 2% (Sawaya et al.; 1998). Existen sin embargo, déficit menores o transitorios, que pueden ser bien tolerados y ser preferibles a la progresión precoz de la enfermedad. En el único trabajo que ha pseudo randomizado más extirpación frente a menos utilizando 5 ala y cirugía guiada por fluorescencia (Stummer et al.; 2006), la extirpación más amplia se acompañó de un aumento de déficit no significativo solo en las primeras semanas. Sin embargo, el KPS empezó a ser mejor en los operados más ampliamente a los 3 meses.
Una cirugía sin complicaciones produce un efecto beneficioso en la calidad de vida, al permitir una desaparición o rápida mejoría de los síntomas (déficit focales, crisis), así como una rápida retirada de corticoides, habitualmente en pocos días.
DIAGNÓSTICO
A pesar de los muchos avances de la neuroimagen, la obtención de tejido tumoral es todavía necesaria para establecer un diagnóstico preciso y para determinar marcadores moleculares. Solo en los gliomas difusos de protuberancia se acepta por muchos autores la posibilidad de iniciar un tratamiento sin histología, ante las características muy específicas de ese tipo de tumor. Aún en este supuesto, algunos grupos abogan por realizar biopsia para determinar marcadores moleculares.
La biopsia puede realizarse por técnica estereotáxica con menores molestias para el paciente, pero en este caso debe recordarse el riesgo de no determinar correctamente el grado del tumor, al ser los gliomas tumores heterogéneos. Con una técnica meticulosa, tanto en quirófano como en laboratorio, es sin embargo posible obtener muestra de suficiente calidad y cantidad para establecer el diagnóstico y realizar los marcadores moleculares necesarios. En años recientes se han obtenido resultados mejores guiando las biopsias con PET con aminoácidos, especialmente metionina, o con espectroscopia de RM. (Pirotte et al.; 2004)
OBTENCIÓN DE MATERIAL DE INVESTIGACIÓN
Especialmente en los gliomas, es necesario un progreso sustancial en su conocimiento para resolver los problemas terapéuticos planteados. La disponibilidad de material suficiente y su conservación adecuada debe ser un objetivo en cada intervención. Aunque todos los equipos de neurooncología reconocen esta necesidad, la realidad es diferente. A modo de ejemplo, en el estudio de Stupp que sirvió para la adopción de RT – TMZ como estándar de tratamiento en GBM, solo pudo determinarse el estado de metilación del promotor MGMT en 206 de 573 pacientes, ya que en los restantes no se disponía de material adecuado.
TÉCNICA QUIRÚRGICA
La cirugía de los tumores del sistema nervioso tiene algunas normas que se apartan bastante de la cirugía oncológica de otras partes del organismo. Las peculiaridades vienen dadas por las características del órgano en el que asientan los tumores. El cerebro resiste muy mal las manipulaciones. Es un tejido blando, que puede desplazarse y deformarse, pero si se excede una presión durante un cierto tiempo, se lesiona. Las lesiones son en general irreversibles. Existe una cierta capacidad de recuperación de daños ligeros y una cierta capacidad de compensar unas funciones de un área con otra, pero las zonas que sufren una lesión completa de tejido no se regeneran, y las compensaciones de algunas áreas no son posibles o lo son de forma muy parcial. Los refinamientos técnicos han permitido trabajar en la vecindad inmediata de un tejido cerebral sano sin dañarlo, por lo que hoy en día es posible la extirpación de una lesión prácticamente en cualquier área.
A la hora de planificar la intervención de un tumor hay que considerar los siguientes aspectos, que se desarrollan a continuación:
VOLUMEN BLANCO
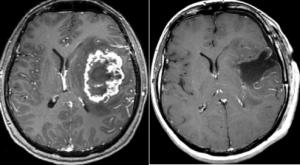
El volumen blanco incluye aquella zona que pensamos que se debe extirpar. Idealmente es el volumen de tumor, pero puede haber ocasiones en las que una parte del tumor se considere no resecable, o no sea posible determinar con precisión los límites del tumor. El principal factor que afecta a la posibilidad de extirpación de un tejido tumoral es que esté o no delimitado del tejido que lo rodea. Si está bien delimitado, es posible establecer un corredor de acceso y extirparlo conservando el tejido vecino, [insular.jpg]
con riesgos que varían de una zona a otra, pero casi siempre aceptables. El verdadero límite a la extirpación son los tumores difusos, o la parte difusa de algunos tumores. Es característica de muchos tumores gliales la presencia de células que infiltran tejido cerebral que se mantiene funcionante. Ese componente no es extirpable (Kelly; 1993).
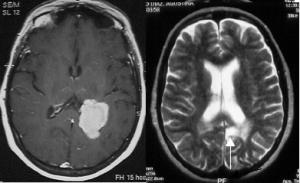
Para la planificación correcta de una cirugía debe determinarse si un tumor está o no en la vecindad de un área elocuente. Las áreas elocuentes son aquellas cuya lesión produce un déficit relevante para el paciente. Incluyen las cortezas motora y sensitiva primaria, áreas de lenguaje, polos occipitales, tálamo, hipotálamo y tronco cerebral. Obviamente todas las partes del cerebro tienen su utilidad y deben conservarse al máximo, pero lesiones fuera de las áreas elocuentes se compensan con facilidad si no suponen un gran volumen de tejido. Normalmente, el volumen blanco para un glioma de alto grado es el área incluida dentro del borde de captación de contraste en T1 con gadolinio, mientras que en los gliomas de bajo grado, el área ideal es la de anomalía en FLAIR, si no llega a áreas elocuentes. En los últimos años han aparecido datos que sugieren que el PET con aminoácidos proporciona volúmenes blancos más precisos, con gran correlación con el pronóstico (Pirotte et al.; 2009) [PET1.jpg].

En los meningiomas, aunque estén histológicamente bien delimitados, puede ocurrir que una parte se considere no extirpable, por invadir la pared de una arteria importante, de un seno venoso o un nervio craneal.
VÍA DE ABORDAJE
El acceso a algunos tumores puede ser obvio, si afloran a la superficie o en el caso de los meningiomas de la convexidad. En otros casos, es necesario diseñar la ruta menos lesiva, que será la que atraviese menos tejido cerebral, y que no lesione zonas elocuentes. Tradicionalmente, la posición de las áreas elocuentes se estimaba por la anatomía, lo cual es impreciso por las variaciones individuales, a las que se pueden añadir las desviaciones debidas a la presencia del tumor. Actualmente puede estudiarse con precisión la función de las áreas inmediatamente adyacentes al tumor para determinar su elocuencia. Este estudio puede hacerse por RM funcional, PET o Magnetoencefalografía. Los estudios de imagen pueden fusionarse con la RM estructural y llevarse a un navegador quirúrgico para su utilización intraoperatoria.
A pesar de la precisión que han alcanzado estas técnicas, si un tumor está a pocos centímetros de un área elocuente, el estándar es realizar un mapeo de la función cortical con monitorización neurofisiológica intraoperatoria. Es posible localizar así con toda precisión las áreas motoras, sensitivas y de lenguaje. En el caso del lenguaje, es preciso hacer la cirugía bajo anestesia local y sedación, técnica que ha pasado de ser excepcional a realizarse de forma rutinaria en bastantes centros (Kim et al.; 2009).
Además de evitar las zonas elocuentes, la selección del abordaje más adecuado puede aprovechar la anatomía cerebral para establecer corredores de acceso no lesivos. Por ejemplo, el acceso interhemisférico permite acceder a la totalidad de la cara medial de los hemisferios sin lesión del cerebro, o al interior de los ventrículos con una pequeña incisión en el tejido o en el cuerpo calloso [cirugia1.jpg];
el acceso transilviano permite separar el lóbulo frontal del temporal sin dañarlos para acceder a la ínsula o al polígono de Willis.
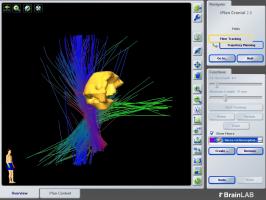
Muy recientemente, se han incorporado a la RM las secuencias de tractografía cerebral con las que es posible ver los grandes haces de sustancia blanca. Esta información permite seleccionar por qué lado de un tumor profundo se provocaría menos lesión en el abordaje, al ver por ejemplo, hacia donde desplaza un tumor la cápsula interna [tractografia1.jpg].
LOCALIZACIÓN INTRAOPERATORIA
Una de las causas tradicionales de incertidumbre y complicaciones durante la cirugía de las lesiones cerebrales era la capacidad para encontrar las lesiones en la zona esperada del campo quirúrgico. Los primeros tumores se “buscaban” a partir de una exploración clínica que orientaba a su localización aproximada, por lo que se requerían grandes craneotomías y a veces múltiples incisiones en el tejido encefálico. A medida que mejoró la imagen con las sucesivas generaciones de TAC y RM, la capacidad de encontrar correctamente lesiones más pequeñas fue mejorando, quedado un margen de error de unos pocos centímetros al correlacionar la anatomía radiológica con la real a partir de referencias como las suturas craneales. Con la utilización amplia de los navegadores quirúrgicos, este margen de error se ha reducido hasta unos pocos milímetros, con lo que el abordaje más adecuado al tumor puede planearse y ejecutarse sin error espacial apreciable. El uso de estos navegadores es ya rutina en casi todos los tumores en los centros neurooncológicos.
A medida que progresa una intervención, el volumen del tejido cerebral y su posición cambian, debido a la extracción de LCR y de tumor. Esto hace que el navegador deje de ser útil, ya que está basado en la RM realizada preoperatoriamente. Para obtener información de imagen en tiempo real se puede recurrir a la ecografía, pero la precisión de esta imagen no es muy alta. En algunos centros de excelencia se cuenta con equipos de RM intraoperatoria que permiten comprobar si se ha extirpado todo el tumor y actualizar la información espacial para continuar trabajando si es preciso. Los primeros equipos utilizados en quirófano fueron resonancias de bajo campo (0,15T), cuya utilidad no ha quedado clara por aportar imágenes de peor calidad con dificultad de diferenciar restos de tumor de artefactos debidos a la propia cirugía. Estas dudas desaparecen si se utilizan resonancias de 1,5T intraoperatorias, quedando como problemas su elevadísimo coste, que las hace inviables para una práctica habitual generalizada y el tiempo que se necesita interrumpir la intervención.
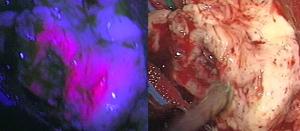
En el glioblastoma, la cirugía guiada por fluorescencia permite ver el tumor en el campo quirúrgico con toda precisión y en tiempo real, con lo que puede aumentar considerablemente el índice de extirpaciones completas [fluorescencia1.jpg].
BIBLIOGRAFÍA
Albert, F.K.M.D., Forsting, M.M.D., Sartor, K.M.D., Adams, H.D.I.M. & Kunze, S.M.D. (1994). Early Postoperative Magnetic Resonance Imaging after Resection of Malignant Glioma: Objective Evaluation of Residual Tumor and Its Influence on Regrowth and Prognosis. Neurosurgery. 34: 45-61.
Chang, S., Parney, I., McDermott, M., Barker, F., Schmidt, M., Huang, W., Laws, E., Lillehei, K., Bernstein, M., Brem, H., Sloan, A. & Berger, M. (2003). Perioperative complications and neurological outcomes of first and second craniotomies among patients enrolled in the Glioma Outcome Project. J Neurosurg. 98: 1175.
Gorlia, T., van den Bent, M.J., Hegi, M.E., Mirimanoff, R.O., Weller, M., Cairncross, J.G., Eisenhauer, E., Belanger, K., Brandes, A.A., Allgeier, A., Lacombe, D. & Stupp, R. (2008). Nomograms for predicting survival of patients with newly diagnosed glioblastoma: prognostic factor analysis of EORTC and NCIC trial 26981-22981/CE.3.The lancet oncology.9:29-38.
Díez Valle, R., Tejada S., Idoate MA., R García de Eulate R., Pablo Domínguez P., Espinos, J., Aristu, J. (2010). Surgery guided by 5-aminolevulinic fluorescence in glioblastoma. Volumetric analysis of extent of resection in single-center experience. J Neuro-oncol., en prensa.
Kelly, P.J. (1993). Computed tomography and histologic limits in glial neoplasms: tumor types and selection for volumetric resection. Surgical neurology. 39:458.
Kim, S.S., McCutcheon, I.E., Suki, D., Weinberg, J.S., Sawaya, R., Lang, F.F., Ferson, D., Heimberger, A.B., DeMonte, F. & Prabhu, S.S. (2009). Awake craniotomy for brain tumors near eloquent cortex: correlation of intraoperative cortical mapping with neurological outcomes in 309 consecutive patients. Neurosurgery. 64: 836-45; discussion 345-6.
Lacroix, M., Abi-Said, D., Fourney, D.R., Gokaslan, Z.L., Shi, W., DeMonte, F., Lang, F.F., McCutcheon, I.E., Hassenbusch, S.J., Holland, E., Hess, K., Michael, C., Miller, D. & Sawaya, R. (2001). A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival.J Neurosurg. 95:190-198.
Pirotte, B., Goldman, S., Massager, N., David, P., Wikler, D., Lipszyc, M., Salmon, I., Brotchi, J. & Levivier, M. (2004). Combined use of 18F-fluorodeoxyglucose and 11C-methionine in 45 positron emission tomography-guided stereotactic brain biopsies. J Neurosurg.101:476-483.
Pirotte, B.J., Levivier, M., Goldman, S., Massager, N., Wikler, D., Dewitte, O., Bruneau, M., Rorive, S., David, P. & Brotchi, J. (2009). Positron emission tomography-guided volumetric resection of supratentorial high-grade gliomas: a survival analysis in 66 consecutive patients.Neurosurgery. 64:471-81; discussion 481.
Sanai, N. & Berger, M.S. (2008). Glioma extent of resection and its impact on patient outcome. Neurosurgery.62:753-64; discussion 264-6.
Sawaya, R., Hammoud, M., Schoppa, D., Hess, K.R., Wu, S.Z., Shi, W.M. & Wildrick, D.M. (1998). Neurosurgical outcomes in a modern series of 400 craniotomies for treatment of parenchymal tumors.Neurosurger.42:1044-55; discussion 1055-6.
Smith, J.S., Chang, E.F., Lamborn, K.R., Chang, S.M., Prados, M.D., Cha, S., Tihan, T., Vandenberg, S., McDermott, M.W. & Berger, M.S. (2008). Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol.26:1338-1345.
Stummer, W., Pichlmeier, U., Meinel, T., Wiestler, O.D., Zanella, F., Reulen, H.J. & ALA-Glioma Study Group (2006). Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. The lancet oncology.7:392-401.
Stummer, W., Reulen, H.J., Meinel, T., Pichlmeier, U., Schumacher, W., Tonn, J.C., Rohde, V., Oppel, F., Turowski, B., Woiciechowsky, C., Franz, K., Pietsch, T. & ALA-Glioma Study Group (2008). Extent of resection and survival in glioblastoma multiforme: identification of and adjustment for bias. Neurosurgery. 62:564-76; discussion 564-76.
Stupp, R., Hegi, M.E., Mason, W.P., van den Bent, M.J., Taphoorn, M.J., Janzer, R.C., Ludwin, S.K., Allgeier, A., Fisher, B., Belanger, K., Hau, P., Brandes, A.A., Gijtenbeek, J., Marosi, C., Vecht, C.J., Mokhtari, K., Wesseling, P., Villa, S., Eisenhauer, E., Gorlia, T., Weller, M., Lacombe, D., Cairncross, J.G., Mirimanoff, R.O., European Organisation for Research and Treatment of Cancer Brain Tumour and Radiation Oncology Groups & National Cancer Institute of Canada Clinical Trials Group (2009). Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. The lancet oncology.10: 459-466.