Metástasis cerebrales
RESUMEN
Las metástasis (MTS) cerebrales son los tumores más frecuentes del SNC. Se diagnostican en el 8-10% de los pacientes con cáncer, aunque su frecuencia en estudios de autopsia es todavía mayor. Las MTS cerebrales más frecuentes son las de pulmón, mama y melanoma. Se producen por diseminación de las células tumorales por vía hematógena, y su localización más frecuente es la unión córtico-subcortical de los hemisferios cerebrales. La técnica diagnóstica de elección es la RM craneal con contraste.
En la actualidad no se dispone de tratamientos con intención curativa, pero las modalidades terapéuticas empleadas han demostrado beneficio en términos de supervivencia, mejoría funcional y/o disminución de recidivas en diversos ensayos clínicos. El tratamiento óptimo de las MTS cerebrales depende de su número, tamaño, localización, actividad del cáncer sistémico, situación funcional del paciente y comorbilidad. La resección quirúgica debe considerarse en pacientes seleccionados con 1-3 MTS, localización favorable, enfermedad sistémica controlada y buena situación funcional. La radiocirugía es una alternativa de tratamiento local en enfermedad metastásica limitada, especialmente cuando el tamaño es pequeño y la localización profunda. La RT holocraneal se emplea como tratamiento adyuvante asociado a resección quirúrgica o radiocirugía, o como tratamiento único en pacientes con MTS múltiples, enfermedad sistémica de mal pronóstico o mala situación funcional. La quimioterapia convencional y las nuevas terapias dirigidas pueden ser una opción de tratamiento en determinados casos.
Un componente fundamental del tratamiento del paciente con MTS cerebrales es el manejo correcto de los tratamientos de soporte. El tratamiento antiedema con dexametasona consigue mejoría clínica en pacientes sintomáticos y se emplea como tratamiento del edema y radionecrosis post radioterapia; debe mantenerse sólo el tiempo que sea imprescindible para evitar los efectos secundarios de su empleo crónico. La profilaxis primaria con anticomiciales no está indicada, aunque existen excepciones en la práctica clínica. Cuando es preciso emplearlos como profilaxis secundaria, debe optarse preferentemente por fármacos no inductores para evitar interacciones con los corticoides y quimioterapia.
Introducción: Epidemiología, Fisiopatología.
EPIDEMIOLOGÍA
Las MTS cerebrales son los tumores más frecuentes del SNC, y una causa importante de morbimortalidad en pacientes con cáncer. Su incidencia es aproximadamente 10 veces mayor que la de los tumores primarios del SNC. En base a estudios de autopsia, se calcula que el 20%-40% de los pacientes con cáncer sistémico las presentan, aunque las metástasis cerebrales sintomáticas aparecen en un porcentaje menor de casos (8-10%) (Brem et al; 2011).
Los cánceres sistémicos que con mayor frecuencia se asocian a MTS cerebrales en adultos son el cáncer de pulmón, mama y melanoma. Con menor frecuencia metastatizan el cáncer de colon y riñón, y en general cualquier tumor maligno tiene la capacidad de causar MTS cerebrales. Hasta un 15% de las MTS cerebrales son de origen desconocido. Según su momento de aparición con respecto al diagnóstico del cáncer sistémico, la mayoría de las MTS cerebrales se diagnostican en pacientes con cáncer ya conocido (70%, presentación metácrona), y con menor frecuencia (30%) se diagnostican de manera síncrona o antes que el cáncer sistémico (Soffietti et al; 2011).
FISIOPATOLOGÍA
La mayor parte de las MTS cerebrales aparecen en los hemisferios cerebrales (80%), seguido del cerebelo (15%) y del tronco del encéfalo (5%). Es más frecuente la presentación en forma de metástasis múltiples.
La diseminación de las células tumorales al cerebro se realiza por vía hematógena, localizándose los depósitos típicamente en la unión córtico-subcortical, debido al menor calibre de los vasos sanguíneos.
Manifestaciones Clínicas y Diagnóstico de las metástasis cerebrales.
MANIFESTACIONES CLÍNICAS
Los signos y síntomas de las MTS cerebrales son los típicos de cualquier lesión ocupante de espacio en esta localización, incluyendo cefalea, déficit focal progresivo y crisis comiciales. Otras formas de presentación menos frecuentes son como déficit focal agudo simulando un ictus (habitualmente por sangrado intratumoral) o como una encefalopatía difusa con alteración del nivel de conciencia y dificultades cognitivas en pacientes con MTS múltiples o incremento de la presión intracraneal (Soffietti et al; 2011).
DIAGNÓSTICO
La técnica diagnóstica de elección es la RM craneal con gadolinio. La TC craneal es una técnica de imagen particularmente útil en urgencias en situaciones como las siguientes: a) diagnóstico diferencial de MTS cerebrales frente a otras complicaciones en un paciente oncológico con síntomas neurológicos de reciente aparición; b) detección de sangrado agudo sobre MTS cerebral; y c) desarrollo o empeoramiento de edema perilesional. Sin embargo, su sensibilidad es más baja que la de la RM para la detección de MTS múltiples, en especial las de menor tamaño o localizadas en fosa posterior. Por este motivo, es necesaria la realización de RM craneal siempre que no esté contraindicada para la toma de decisiones terapéuticas.
Los hallazgos radiológicos no son patognomónicos. La imagen típica en TC y RM es una o varias lesiones redondeadas con captación de contraste en anillo y edema perilesional prominente. El diagnóstico diferencial incluye tumores cerebrales primarios (gliomas de alto grado, linfoma) y lesiones no neoplásicas (abscesos, lesiones desmielinizantes y vasculares). La secuencia de RM de difusión puede ayudar al diagnóstico diferencial de abscesos cerebrales frente a lesiones tumorales al mostrar restricción de la difusión en el interior del absceso, aunque este hallazgo tampoco es específico.
Ante un paciente con una o múltiples lesiones cerebrales sugerentes de MTS pero sin primario conocido, es necesario realizar un estudio sistémico cuidadoso para búsqueda del tumor primario (radiografía de tórax, TC de tórax, abdomen y/o pelvis, etc). En caso de negatividad de otras pruebas, puede ser útil la realización de FDG-PET o incluso de biopsia cerebral. La biopsia cerebral puede ser también de utilidad en pacientes con cáncer conocido y lesiones cerebrales que planteen dudas de diagnóstico diferencial.
Tras el diagnóstico y tratamiento, se recomienda seguimiento mediante RM craneal cada 3 meses durante el primer año, y luego según sea preciso clínicamente (Brem et al; 2011). En ocasiones puede ser difícil distinguir recurrencia tumoral de los efectos del propio tratamiento (radionecrosis), por lo que puede estar indicada la realización de biopsia o resección tumoral.
Tratamiento de las metástasis cerebrales.
El tratamiento óptimo de las MTS cerebrales depende de su número, tamaño, localización, actividad del cáncer sistémico, situación funcional del paciente y comorbilidad. No existe en la actualidad ningún tratamiento con intención curativa. Los ejes principales de la terapia son: a) los tratamientos destinados a actuar sobre las propias MTS y/o prevenir su recidiva (resección quirúrgica, radiocirugía, radioterapia holocraneal, quimioterapia); y b) el tratamiento de soporte (corticoides, anticomiciales, etc).
TRATAMIENTO DE MTS CEREBRAL ÚNICA
- Resección quirúrgica
La resección quirúrgica es el tratamiento de elección para pacientes con una única MTS cerebral, siempre que la situación del paciente (extensión del cáncer sistémico, situación funcional, comorbilidad) y la localización de la lesión lo permitan (Patchell et al; 1990) (Vecht et al; 1993) (Mintz et al; 1996). Además de un beneficio en términos de supervivencia, la resección quirúrgica permite en muchos casos la mejoría de los síntomas de hipertensión intracraneal, déficit focales y crisis, y una reducción rápida del tratamiento con corticoides (Soffietti et al; 2011).
El tratamiento adyuvante con RT holocraneal tras resección quirúrgica completa de MTS cerebral única ha demostrado una clara disminución de la recurrencia tumoral y de los fallecimientos de causa neurológica frente a cirugía sola, aunque no se ha observado un impacto sobre la supervivencia global ni sobre el mantenimiento de la independencia funcional, por lo que sigue existiendo controversia en cuanto a su empleo en primera línea (Patchell et al; 1998) (Kocher at al; 2011) (Soffietti et al; 2011).
- Radiocirugía
La radiocirugía mediante gamma-knife o acelerador lineal es una opción de tratamiento atractiva en pacientes con MTS cerebral única, especialmente cuando es de pequeño tamaño (menor de 3-3.5 cm de diámetro) y de localización profunda (ganglios de la base, tronco del encéfalo) o en áreas elocuentes. Su principal ventaja frente a la cirugía es su menor morbilidad inmediata, aunque existe la posibilidad de morbilidad retardada (edema cerebral, radionecrosis, efectos secundarios de la administración crónica de corticoides). Un estudio prospectivo randomizado ha demostrado superioridad del tratamiento con radiocirugía asociada a radioterapia holocraneal frente a radioterapia holocraneal sola en pacientes con 1-3 MTS cerebrales (Andrews et al; 2004). No se han realizado ensayos clínicos prospectivos randomizados comparando resección quirúrgica frente a radiocirugía en estos pacientes. Sin embargo, la evidencia disponible en base a estudios retrospectivos comparativos apunta a supervivencias similares en pacientes tratados con cirugía o radiocirugía, seguidos en ambos casos por RT holocraneal (Brem et al; 2011). En la práctica, la elección de un tratamiento o el otro depende de múltiples factores, como el tamaño y localización de la lesión, comorbilidad del paciente, y disponibilidad o experiencia del equipo médico.
Al igual que en el caso de la resección quirúrgica, la RT holocraneal asociada a radiocirugía no ha demostrado un claro beneficio en cuanto a supervivencia en todos los estudios, pero sí disminuye las recurrencias y reduce el riesgo de otras MTS (Andrews et al; 2004) (Aoyama et al; 2006) (Kocher at al; 2011).
- Radioterapia holocraneal
Para los pacientes con MTS cerebral única pero con localización desfavorable, enfermedad sistémica extensa de mal pronóstico o comorbilidad significativa, el tratamiento de elección es la RT holocraneal. Para pacientes con muy pobre situación funcional puede emplearse únicamente tratamiento de soporte.
TRATAMIENTO DE MTS CEREBRALES MÚLTIPLES
En el caso de MTS cerebrales múltiples, la cirugía se limita habitualmente a la obtención de biopsia en casos de duda diagnóstica o a cirugía descompresiva para aliviar el efecto masa. Sin embargo, existe evidencia en base a estudios retrospectivos que apoya el empleo de cirugía en pacientes seleccionados con enfermedad oligometastásica (hasta 3 MTS cerebrales) (Paek et al; 2005) (Stark et al; 2005). Así mismo, el tratamiento con radiocirugía es también una opción en pacientes con menos de 3 MTS.
El tratamiento de elección de los pacientes con MTS cerebrales múltiples (>3) es la RT holocraneal, habitualmente 30 Gy en 10 fracciones. Para pacientes con mala situación funcional puede valorarse el empleo de un curso acelerado de tratamiento (20 Gy en 5 fracciones) (Brem et al; 2011). En pacientes con muy mal pronóstico puede estar indicado el empleo de tratamiento sintomático únicamente (Soffietti at al; 2011).
PAPEL DE LA QUIMIOTERAPIA EN EL TRATAMIENTO DE LAS MTS CEREBRALES
En general, la quimioterapia sistémica tiene un papel limitado en el tratamiento de las MTS cerebrales. Esto es probablemente debido a la dificultad de penetración de la mayoría de estos fármacos a través de la barrera hematoencefálica y a la habitual quimiorresistencia de la enfermedad oncológica diseminada que ha recibido múltiples tratamientos previos (Brem et al; 2011). Suele reservarse como última opción terapéutica cuando han fallado o no pueden aplicarse otras modalidades de tratamiento (cirugía, radiocirugía, RT holocraneal). También puede emplearse como tratamiento inicial en pacientes con tumores quimiosensibles (p.ej. tumores de células germinales, linfomas, cáncer de pulmón de células pequeñas, cáncer de mama), especialmente si el paciente no ha recibido nunca quimioterapia o si no se ha usado todavía una opción eficaz (Soffietti et al; 2011).
La adición de quimioterapia sistémica a RT holocraneal como tratamiento de primera línea no ha demostrado mejorar la supervivencia frente a RT sola, aunque sí prolongación del tiempo a la recurrencia o incremento de la respuesta radiológica en algunos estudios con temozolomida (Verger et al; 2005) (Antonadou et al; 2002), pareciendo particularmente útil en los pacientes con melanoma metastásico (Agarwala et al; 2004).
La quimioterapia local con Gliadel® (obleas impregnadas de BCNU) tras resección quirúrgica parece reducir el riesgo de recurrencia local (Ewend et al; 2007).
Las nuevas terapias dirigidas o de diana molecular también han sido investigadas en pacientes con MTS cerebrales. El tratamiento con inhibidores de EGFR (receptor del factor de crecimiento epidérmico) gefitinib y erlotinib consigue respuestas en pacientes con MTS cerebrales de cáncer de pulmón (Ceresoli et al; 2004) (Fekrazad et al; 2007). Al igual que en la enfermedad extracraneal, la probabilidad de respuesta se ha visto asociada a la presencia de mutaciones activadoras en el dominio tirosín-quinasa del gen de EGFR (Shimato et al; 2006) (Porta et al; 2011). En el caso del cáncer de mama, el inhibidor dual de EGFR y HER2 lapatinib ha mostrado actividad en pacientes con tumor her2 positivo tras tratamiento con trastuzumab y radioterapia holocraneal (Lin et al; 2009).
TRATAMIENTO DE SOPORTE DEL PACIENTE CON MTS CEREBRALES
- Edema cerebral:
La dexametasona es el corticoide de elección para el tratamiento del edema cerebral asociado a MTS cerebrales, debido a su larga vida media y su mínima acción mineralocorticoide. La dosis habitual de inicio es de 4-8 mg al día, repartida en 2 dosis. En pacientes con síntomas graves (alteración del nivel de conciencia, hipertensión intracraneal) pueden ser necesarias dosis mayores (≥16 mg/día). En general, no se recomienda tratamiento si el paciente está asintomático. Al igual que en los tumores cerebrales primarios, debe mantenerse la menor dosis posible durante el menor tiempo posible para evitar o disminuir los efectos secundarios del tratamiento crónico.
- Crisis comiciales:
No está indicado el tratamiento anticomicial como profilaxis primaria en pacientes con MTS cerebrales (Glantz et al; 2000). En pacientes sometidos a intervención quirúrgica tampoco se ha demostrado la necesidad de profilaxis primaria, por lo que se recomienda su suspensión 1 semana tras la cirugía (Kuijlen et al; 1996). Sin embargo, y a pesar de que no se dispone de evidencia firme que avale su uso, es frecuente en la práctica clínica el empleo de profilaxis primaria en pacientes con mayor riesgo de desarrollo de crisis (melanoma metastásico, MTS hemorrágicas, MTS múltiples). Para la prevención secundaria se recomienda el empleo de fármacos no inductores para evitar interacciones con otros tratamientos (corticoides, quimioterapia).
- Tromboembolismo venoso:
El tratamiento con heparinas de bajo peso molecular es tan efectivo y seguro como la heparina intravenosa no fraccionada en el tratamiento inicial tras un proceso tromboembólico agudo. Para la prevención de recurrencias, el tratamiento con heparinas de bajo peso molecular ha demostrado mayor eficacia que los anticoagulantes orales en pacientes con cáncer. La duración del tratamiento no está claramente establecida, pero se recomiendan unos 3-6 meses. Se recomienda tratamiento profiláctico en pacientes que van a ser sometidos a cirugía (Soffietti et al; 2011).
TRATAMIENTO PREVENTIVO DE MTS CEREBRALES: PAPEL DE LA RT HOLOCRANEAL PROFILÁCTICA
La RT holocraneal se emplea como tratamiento preventivo de la aparición de MTS cerebrales en pacientes con cáncer de pulmón y un alto riesgo de desarrollarlas. En pacientes con cáncer microcítico de pulmón con enfermedad localizada y en remisión completa tras tratamiento inicial, la radioterapia holocraneal profiláctica disminuye la aparición de MTS cerebrales y mejora la supervivencia y el intervalo libre de enfermedad (The Prophylactic Cranial Irradiation Overview Collaborative Group, Cochrane Systematic Review; 2000). En el caso del cáncer de pulmón no microcítico, existe mayor controversia en cuanto a su empleo, ya que ha demostrado disminución en la incidencia de MTS cerebrales, pero no un impacto en la supervivencia (Patel et al, Cochrane Systematic Review; 2005). Por ello, se considera que no existe suficiente evidencia para su empleo en la práctica clínica.
Pronóstico de las MTS cerebrales
Si no se aplica ningún tratamiento, el pronóstico del paciente con MTS cerebrales es muy malo, habiéndose descrito una mediana de supervivencia de unas 4-6 semanas (Soffietti et al; 2011). Sin embargo, el pronóstico de los pacientes con MTS cerebrales ha mejorado en las últimas décadas gracias a los avances en las técnicas diagnósticas y terapéuticas. De este modo, no es excepcional conseguir estabilización o mejoría clínica con tratamiento, y que el paciente fallezca por otras causas.
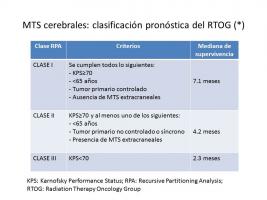
Los factores pronóstico más importantes son: buena situación funcional del paciente, ausencia de MTS sistémicas, tumor primario controlado y edad joven. En base al análisis de estos factores en 1.176 pacientes incluidos en tres estudios del RTOG, se han identificado 3 subgrupos de pacientes con distinto pronóstico (Gaspar et al; 1997). Más recientemente se ha descrito un nuevo índice pronóstico denominado GPA (“grade prognostic assessment”), que además de la edad, situación funcional y existencia de MTS extracraneales, tiene en cuenta el número de MTS craneales (Sperduto et al; 2008). Además de estos factores, se sabe que la función neurocognitiva posee también papel pronóstico (Murray et al; 2000) (Meyers et al; 2004).
BIBLIOGRAFÍA
Agarwala SS, Kirkwood JM, Gore M, et al (2004). Temozolomide for the treatment of brain metastases associated with metastatic melanoma: a phase II study. J Clin Oncol. 22: 2101–2107.
Andrews DW, Scott CB, Sperduto PW, et al (2004). Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase III results of the RTOG randomised trial. Lancet. 363: 1665–1672.
Antonadou D, Paraskevaidis M, Sarris G, et al (2002). Phase II randomized trial of temozolomide and concurrent radiotherapy in patients with brain metastases. J Clin Onco. 20:3644–3650.
Aoyama H, Shirato H, Tago M, et al (2006). Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases: a randomized controlled trial. JAMA. 295: 2483–2491.
Brem SS,Bierman PJ, Brem H, et al (2011). NCCN Clinical Practice Guidelines in Oncology for Central Nervous System Cancers. JNCCN–Journal of the National Comprehensive Cancer Network. 9 (4); 352-400.
Ceresoli G, Cappuzzo F, Gregorc V, et al (2004). Gefitinib in patients with brain metastases from non-small cell lung cancer: a prospective trial. Ann Oncol. 15: 1042–7.
Fekrazad MH, Ravindranathan M , Jones DV Jr (2007). Response of intracranial metastases to erlotinib therapy. J Clin Oncol. 25: 5024–6.
Ewend MG , Brem S , Gilbert M, et al (2007). Treatment of single brain metastasis with resection, intracavity carmustine polymer wafers, and radiation therapy is safe and provides excellent local control. Clin Cancer Res. 13: 3637–41.
Gaspar L, Scott C, Rotman M, et al (1997). Recursive partitioning analysis (RPA) of prognostic factors in three Radiation Therapy Oncology Group (RTOG) brain metastases trials. International Journal of Radiation Oncology, Biology, Physics.37: 745–751.
Glantz MJ, Cole BF, Forsyth PA et al (2000). Practice parameter: anticonvulsant prophylaxis in patients with newly diagnosed brain tumors. Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 54: 1886–1893.
Kocher M, Soffietti R, Abacioglu U, et al (2011). Adjuvant Whole-Brain Radiotherapy Versus Observation After Radiosurgery or Surgical Resection of One to Three Cerebral Metastases: Results of the EORTC 22952-26001 Study. J Clin Oncol. 29 (2): 121-124.
Kuijlen JM, Teernstra OP, Kessels AG, et al (1996). Effectiveness of antiepileptic prophylaxis used with supratentorial craniotomies: a meta-analysis. Seizure. 5: 291–298.
Lin NU, Di é ras V, Paul D, et al (2009). Multicenter phase II study of lapatinib in patients with brain metastases from HER2- positive breast cancer. Clin Cancer Res. 15:1452–9.
Meyers CA, Smith JA, Bezjak A et al (2004). Neurocognitive function and progression in patients with brain metastases treated with whole brain radiation and motexafin gadolinium: results of a randomized phase III trial. Journal of Clinical Oncology. 22: 157–165.
Mintz AH, Kestle J, Rathbone MP, et al (1996). A randomized trial to assess the efficacy of surgery in addition to radiotherapy in patients with a single cerebral metastasis. Cancer. 78: 1470–1476.
Murray KJ, Scott C, Zachariah B et al (2000). Importance of the Mini-Mental Status Examination in the treatment of patients with brain metastases: a report from the RadiationTherapy Oncology Group protocol. International Journal of Radiation Oncology, Biology, Physics. 48: 59–64.
Paek SH, Audu PB, Sperling MR, et al (2005). Reevaluation of surgery for the treatment of brain metastases: review of 208 patients with single or multiple brain metastases treated at one institution with modern neurosurgical techniques. Neurosurgery. 56:1021– 1034.
Patel N, Lester JF, Coles B, Macbeth F (2005). Prophylactic cranial irradiation for preventing brain metastases in patients undergoing radical treatment for non-small cell lung cancer. Cochrane Database of Systematic Reviews 2005, Issue 2. Art. No.: CD005221. DOI: 10.1002/14651858.CD005221.
Patchell RA, Tibbs PA, Walsh JW, et al (1990). A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med. 322:494–500.
Patchell RA, Tibbs PA, Regine WF, et al (1998). Postoperative radiotherapy in the treatment of single metastases to the brain: a randomized trial. JAMA. 280:1485–1489.
Porta R, Sánchez-Torres JM, Paz-Ares L et al (2011). Brain metastases from lung cancer responding to erlotinib: the importance of EGFR mutation. Eur Respir J. 37:624-31.
Shimato S, Mitsudomi T, Kosaka T, et al (2006). EGFR mutations in patients with brain metastases from lung cancer: association with the efficacy of gefitinib. Neurooncology. 8: 137–44.
Soffietti R, Cornu P, Delattre JY, et al (2011).Brain metastases. En: Gilhus NE, Barnes MP, Brainin M (Ed), European Handbook of Neurological Management: Volume 1, 2nd Edition, (pp 437-445). Blackwell Publishing Ltd.
Sperduto PW , Berkey B , Gaspar LE, et al (2008). A new prognostic index and comparison to three other indices for patients with brain metastases: an analysis of 1960 patients in the RTOG database. Int J Radiat Oncol Biol Phys 2008; 70: 510 – 4.
Stark AM, Tscheslog H, Buhl R, et al (2005). Surgical treatment for brain metastases: prognostic factors and survival in 177 patients. Neurosurg Rev. 28:115–119.
The Prophylactic Cranial Irradiation Overview Collaborative Group (2000). Cranial irradiation for preventing brain metastases of small cell lung cancer in patients in complete remission. Cochrane Database of Systematic Reviews 2000, Issue 4. Art. No.: CD002805. DOI: 10.1002/14651858.CD002805
Vecht CJ, Haaxma-Reiche H, Noordijk EM, et al (1993). Treatment of single brain metastasis: radiotherapy alone or combined with neurosurgery? Ann Neurol. 33: 583–590.
Verger E, Gil M, Yaya R, et al (2005). Temozolomide and concomitant whole brain radiotherapy in patients with brain metastases: a phase II randomized trial. Int J Radiat Oncol Biol Phys. 61:185–191.
- 89514 lecturas