Epidemiologia de los tumores primarios del sistema nervioso
RESUMEN
En España, las tasas de incidencia de los tumores del SNC oscilan entre el 5.70 y el 9.63 en hombres y entre el 4.71 y el 6.95 en mujeres. Las tasas de incidencia por histología varían en función del tipo de publicación, el año en que se realizó el análisis o el número de pacientes registrados con tumores del SNC sin confirmación histológica. Sin embargo, en todas las series los tumores más frecuentes son los gliomas, y dentro de ellos los glioblastomas. En cuanto a la edad de presentación, los tumores del SNC muestran una distribución bimodal, con un pico en la edad pediátrica y un aumento progresivo de la incidencia en los adultos, hasta alcanzar su máximo entre la sexta y la séptima década de la vida.
La incidencia de los tumores del SNC presenta una tendencia a incrementarse debido a una mayor longevidad de la población. No se puede excluir que la implantación casi universal de la RM haya influido en esta tendencia, lo que significaría que lo que realmente ha aumentado es el número de casos diagnosticados. Esta mejora en las técnicas de imagen también puede ser la responsable del incremento de pacientes sin estudio histológico. En los próximos años cabe esperar una mejoría en la supervivencia como consecuencia de la aplicación sistemática de los nuevos progresos terapéuticos.
El único factor de riesgo claramente establecido para el desarrollo de tumores primarios del SNC es la exposición a radiaciones ionizantes terapéuticas. El porcentaje de casos asociados a enfermedades genéticas conocidas es inferior al 5% de los casos, aunque también se ha descrito agregación familiar en pacientes con gliomas, apuntando a la existencia de polimorfismos genéticos predisponentes a su desarrollo.
La correcta clasificación y gradación histológica de los tumores primarios del sistema nervioso permite una primera aproximación a su comportamiento biológico y pronóstico y al establecimiento de la indicación terapéutica. Desde su primera publicación en 1979, la clasificación de la Organización Mundial de la Salud (OMS) incluye un sistema de gradación histológica que constituye hoy en día el sistema más empleado. La última clasificación actualizada de la OMS ha sido publicada en el año 2007 (Louis et al.; 2007), y es la empleada en esta obra.
INTRODUCCIÓN A LA EPIDEMIOLOGÍA
El interés por el estudio de los tumores del SNC se ha renovado durante la última década, debido al desarrollo de nuevos tratamientos quirúrgicos, radioterápicos y quimioterápicos (Stupp et al; 2005, Vredenbourgh et al; 2007, Westphal et al; 2003), cuya aplicación a la práctica clínica habitual se ha traducido en una mejoria significativa de la supervivencia de algunos grupos de pacientes afectos de tumores del SNC. Así mismo, el creciente desarrollo de ensayos clínicos en este grupo de pacientes con nuevos fármacos y nuevos esquemas de tratamiento permitirá en un futuro mejorar todavía más su pronóstico.
A pesar de este gran potencial de mejora, la realidad clínica no siempre es todo lo buena que sería deseable, como se desprende de algunos estudios recientes que evalúan qué sucede cuando un paciente diagnosticado de un tumor cerebral accede al sistema sanitario (Barnholz-Sloan et al; 2008, Chang et al; 2005).
Es importante tener en cuenta que para proporcionar a estos enfermos la asistencia óptima que cada caso requiere, es imprescindible disponer de información de calidad en cuanto a la incidencia, prevalencia y supervivencia de los tumores del SNC, tal y como se resalta por parte del Consensus From the Brain Tumor Epidemiology Consortium (Bondy et al; 2008).
Los tumores del SNC constituyen un grupo muy heterogéneo de entidades patológicas cuya clasificación se ha ido modificando a lo largo de los años, siendo la más reciente la publicada por la OMS en el año 2007 (Ohgaki et al; 2007) [Link a 3.2.1.2. Clasificación de los tumores primarios del sistema nervioso]. Así mismo los métodos diagnósticos también se han modificado notablemente en los últimos años, y en especial con la generalización del uso de la resonancia magnética (RM) se ha incrementado el diagnóstico de los tumores del SNC. Paralelamente, ha aumentado también el número de pacientes sin confirmación histológica, en los que el diagnóstico se ha basado únicamente en las pruebas de imagen (Helseth et al; 1989).
EPIDEMIOLOGÍA DESCRIPTIVA
Los dos parámetros epidemiológicos básicos son la incidencia y la mortalidad. La incidencia describe el número de casos nuevos diagnosticados en relación a una población por intervalo de tiempo y se expresa en número de casos nuevos por 100.000 habitantes y año. La incidencia se suele obtener a partir de los informes anatomopatológicos y altas hospitalarias, en tanto que la mortalidad se calcula a partir de los certificados de defunción. Los datos epidemiológicos más fiables son los publicados por los registros poblacionales de cáncer. En nuestro país, existe un total de 14 registros de base poblacional.
Las fuentes fundamentales de información en referencia a la epidemiología del cáncer proceden de las publicaciones Cancer Incidence in Five Countries y EUROCIM (Martínez García et al; 2003). En Europa se dispone del registro Francés FRANCIM y de algunas publicaciones que han aparecido a lo largo de los años desde el primer estudio de base poblacional islandés (1954-1963) (Guomundsson KR; 1970, Kallio; 1988, Joensen P; 1981, Helseth et al; 1989, Fleury A; 1997).
En Estados Unidos existe una publicación periódica dedicada exclusivamente a los tumores del SNC por parte del Central Brain Tumor Registry of the United States (www.cbtrus.org ).
En este artículo centraremos nuestro interés en los datos disponibles a nivel de Europa y España.
Incidencia.
De acuerdo con los datos publicados por el SEER, Surveillance Epidemiology and End Results (http://seer.cancer.gov/), en el periodo 1996-2000 la incidencia combinada de tumores del SNC en EEUU fue de 6,6 casos nuevos por 100.000 habitantes-año, en tanto que la mortalidad se estimó del 4,7 por 100.000 habitantes/año.
Los datos referentes a la incidencia de los tumores del SNC hay que interpretarlos en el contexto del momento en que se han obtenido y/o publicado, dado que un aumento en la incidencia puede que únicamente signifique un aumento de los pacientes diagnosticados debido a un mejor acceso a técnicas diagnósticas.
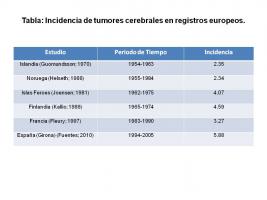
En Europa, el primer estudio que se encuentra en la literatura relativo a la incidencia de tumores del SNC se debe a Guomundsson (Guomundsson et al; 1970), que en 1970 publicó los datos obtenidos a través del registro de tumores de Islandia correspondiente al periodo 1954-1960. Durante este intervalo de tiempo el TAC no existía y la clasificación histológica era distinta de la actual. La incidencia fue de 2.35 casos por 100.000 habitantes-año. Las incidencias publicadas posteriormente por otros países europeos revelaron un aumento en el número de casos registrados. No obstante, los datos procedentes de estas publicaciones son difícilmente comparables, dado que los métodos diagnósticos han cambiado notablemente a lo largo de las últimas décadas. Así mismo, entre cada una de las publicaciones han pasado varios años [Tabla: Incidencia de tumores cerebrales en registros europeos.jpg].
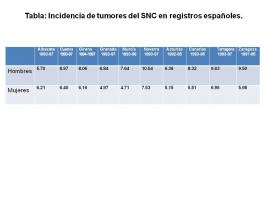
A nivel del estado español, las tasas de incidencia ajustadas por edad a la población estándar mundial de los tumores del SNC, según las publicaciones de 10 registros de tumores, oscilan entre el 5.70 y el 9.63 para hombres y entre el 4.71 y el 6.95 para mujeres [Tabla: Incidencia de tumores del SNC en registros españoles.jpg]. La incidencia anual estandarizada por edad y publicada por el Brain Tumor Epidemiology Consortium es de 3.7 casos por 100.000 hombres-año y de 2.6 para las mujeres; en los países más desarrollados es de 5.8 para hombres y 4.1 para mujeres (Bondy et al.; 2008).
Incidencia por histología
Las tasas de incidencia por histología de los tumores del SNC varían en función de varios factores, entre los cuales cabe destacar el tipo de publicación, el año en que se realizó el análisis o el número de pacientes registrados con tumores del SNC sin confirmación histológica.
En el caso de los datos de incidencia publicados por el CBTRUS 2004-2005 (que agrupa un total de 39 registros de cáncer en EEUU), el porcentaje de tumores considerados no malignos varía entre el 47 y el 70%. Sólo en un 69% de los casos registrados, los casos tenían confirmación histológica con una variación del 58 al 97% según los registros, demostrando que existe una gran variabilidad entre los datos publicados, incluso del mismo país.
La incidencia por histologías según el estudio francés FRANCIM (Fleury et al; 1997) incluye un total de 15 entidades patológicas según los códigos de la Clasificación internacional de las enfermedades para la Oncología (ICD-O), aunque posteriormente los reagrupa en: astrocitomas malignos (55.5%), astrocitomas de bajo grado (12.9%), oligodendrogliomas/mixtos (7.7%) y tumores sin confirmación histológica (18.9%).
En el caso de los datos del CBTRUS, el número de subgrupos es mayor y los datos publicados incluyen todos los grupos de edad: glioblastoma (17.6%), astrocitomas (7.4%), ependimomas (1.9%), oligodendrogliomas (2.1%), embrionarios (1.0%), craneofaringioma (0.8%), tumores de las vainas nerviosas (8.7%), linfoma (2.5%), tumores de hipófisis (12.2%), meningiomas (33.4%) y otros (12.4%).
En el estudio del Registro del Cáncer de Girona se excluyeron los linfomas y los meningiomas del grupo estudiado. Durante el periodo 1994-2004, la distribución por histologías fue: tumores astrocitarios (49.3%), oligodendrogliomas y oligoastrocitomas (3.4%), tumores ependimarios (2.6%), embrionarios (3.7%) y tumores sin confirmación histológica (41.0%).
Incidencia por edad
La incidencia global de los tumores del SNC es bimodal, con un pico en la edad pediátrica y un aumento progresivo de la incidencia en los adultos que empieza sobre los 30 años, hasta alcanzar su máximo entre la sexta y la séptima década de la vida.
Respecto a la correlación entre incidencia por edad y tipo histológico, no existen grandes variaciones respecto a los datos publicados por los distintos registros.
En el registro CBTRUS, entre 0 y 14 años los tumores más frecuentes son los embrionarios, meduloblastomas y astrocitoma pilocítico; entre los 15 y los 34 años el tumor más frecuente es el hipofisario y entre los 35 y 85 años es el meningioma. El grupo de edad con una mayor incidencia es el de 75 a 84 años (63.75 por 100.000 habitantes y año), en tanto que la menor corresponde al grupo de 15 a 19 años (4.58 casos por 100.000 habitantes y año). Es importante resaltar que esta distribución se modifica cuando únicamente se incluyen los tumores histológicamente malignos.
Los astrocitomas de bajo grado presentan su máxima incidencia entre los 30-34 años, en tanto que los “astrocitomas malignos” como se les clasifica por parte del FRANCIM (Fleury et al; 1997) tienen su máxima incidencia entre los 60-64 años de edad. Por su parte, los oligodendrogliomas presentan su máxima incidencia entre los 45-49 años.
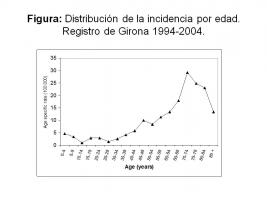
En el análisis del Registro del Cáncer de Girona, el pico de incidencia se encuentra entre los 65 y 70 años (Fuentes et al. 2009) [Figura: Distribución de la incidencia de tumores cerebrales por edad.jpg].
En general, los pacientes sin confirmación histológica son los de mayor edad. En el estudio francés (Fleury el al; 1997) la incidencia más alta de pacientes no biopsiados se sitúa entre los 75-79 años.
Mortalidad.
La mortalidad constituye un parámetro que, de manera indirecta, nos informa de la incidencia de un determinado tumor y su letalidad. Dada la elevada mortalidad de los tumores del SNC, en especial los histológicamente malignos, la incidencia y la mortalidad son parámetros altamente relacionados.
El documento esencial para determinar la mortalidad es el certificado de defunción. Algunos registros recurren a las historias clínicas de los pacientes como información adicional. A pesar de lo que pueda parecer, los certificados de defunción constituyen una fuente de información altamente fiable (Percy et al; 1981; García-Benavides et al; 1989).
En EEUU la mortalidad es de 4.7 por 100.000 personas/año (http://seer.cancer.gov/). En Estados Unidos la mortalidad estandarizada por edad es de 2.8 por 100.000 habitantes/año para los hombres y del 2.0 para mujeres.
Similar a lo que sucede con la incidencia, la mortalidad por tumores del SNC es mayor en los países desarrollados. En éstos, es de 4.1 para hombres y del 2.7 para mujeres por 100.000 habitantes/año, lo cual contrasta con los países menos desarrollados en los que la mortalidad es de 2.2 para hombres y 1.6 para mujeres por 100.000 habitantes/año (Bondy et al; 2008). Los tumores de localización encefálica son los responsables del 97% de la mortalidad.
Respecto a las causas de mortalidad por cáncer, los tumores encefálicos se sitúan en el 10° lugar.
Supervivencia.
La supervivencia es el parámetro que nos explica qué proporción de un determinado grupo de pacientes logra sobrevivir en un tiempo preestablecido. En general se suele especificar a 5 y 10 años, aunque determinados tipos de tumores por su historia natural se pueden definir en periodos más cortos. La supervivencia constituye uno de los parámetros esenciales para valorar la eficacia del sistema sanitario y sus logros en función del tiempo.
Otro término empleado es el de supervivencia relativa, que se obtiene dividiendo la supervivencia observada entre la supervivencia esperada en relación a la mortalidad general de la población.
En EEUU, la supervivencia global de los pacientes con tumores del SNC se sitúa a 5 y 10 años en el 29.1 % y el 25.3%. (http://seer.cancer.gov/). Según EUROCARE-4 (www.eurocare.it), la supervivencia relativa de tumores del SNC en Europa es del 44.9%, 19.6% y 12.8% a 1, 5 y 10 años respectivamente.
En España la supervivencia global a 5 años es del 16%. En Girona, para el periodo 1994-2004, la mediana de supervivencia global a 5 años fue del 15.3%, siendo del 16.5% para las mujeres y del 14.3% para los hombres. Hay que tener en cuenta, que de este análisis se excluyeron los meningiomas y otros tumores histológicamente benignos.
La supervivencia es un factor que se puede analizar por subtipos histológicos. Según el CBTRUS, la supervivencia de los pacientes diagnosticados de glioblastoma es del 3.3% a 5 años; para los astrocitomas pilocíticos, oligodendrogliomas y ependimomas es superior al 70%; para astrocitomas (subtipo no especificado), astrocitomas anaplásicos, glioma maligno (subtipo no especificado) y linfoma la supervivencia es inferior al 40%.
En la serie de Girona (España), la supervivencia a 5 años (IC 95%) fue la siguiente: tumores astrocitarios 14.6%; oligodendrogliomas y oligoastrocitomas 35.7%; tumores ependimarios 41.0%; tumores embrionarios 32.4% y los tumores sin confirmación histológica 7.5%.
Un análisis de los tumores astrocitarios por grado histológico mostro que los glioblastomas presentaban una supervivencia a 5 años del 4.7%, los astrocitomas anaplásicos del 7.1% y los astrocitomas difusos (bajo grado) del 37% (Fuentes et al; 2010).
EPIDEMIOLOGÍA ANALÍTICA (factores de riesgo).
Poco se conoce acerca de la naturaleza y magnitud de los factores de riesgo para el desarrollo de los tumores del SNC. Ciertos síndromes hereditarios, como la esclerosis tuberosa, la neurofibromatosis, el síndrome de Li-Fraumeni y el síndrome de Lynch (cáncer de colon hereditario no polipósico) presentan una incidencia más alta de este tipo de tumores (Bondy et al, 1994). Sin embargo, los tumores del SNC en contexto de enfermedades genéticas hereditarias constituyen un porcentaje muy pequeño de la casuística general. Se ha descrito también la existencia de agregación familiar en la incidencia de este tipo de tumores que iría a favor de una posible etiología genética asociada a ciertos polimorfismos genéticos. Estudios analíticos encuentran una asociación inversa entre la historia personal de enfermedades alérgicas (asma, ezcema y otras) y la incidencia de gliomas (Schlehofer et al, 1999), resultados que se han reproducido en otros estudios, revelando una posible influencia de factores inmunológicos en la génesis de los gliomas.
Aunque no se encuentra una fuerte asociación, se ha descrito también una posible relación causa–efecto con la exposición prenatal a ciertos medicamentos (contraceptivos orales, tranquilizantes, barbitúricos, antihistamínicos).
Otros factores de riesgo descritos serian la exposición profesional y residencial a ciertos componentes químicos (pesticidas, insecticidas, fungicidas, herbicidas). Las radiaciones ionizantes terapéuticas son un importante factor de riesgo y el único factor ambiental claramente establecido. Bajas dosis de radiación usadas para tratar tiña capitis o hemangiomas en la infancia se ha asociado con riesgo elevado de tumores del sistema nervioso central (Preston-Martin and Mack et al, 1996). Así mismo, se ha observado un aumento en la incidencia de gliomas y otros tumores cerebrales en niños con leucemias agudas tratados con radioterapia craneal profiláctica.
BIBLIOGRAFÍA
Barnholtz-Sloan JS, Williams VL, Maldonado JL, Shahani D, Stockwell HG, Chamberlain M, et al. (2008). Patterns of care and outcomes among elderly individuals with primary malignant astrocytoma. J Neurosurg.108(4): 642-8.
Bondy, M., Wiencke, J., Wrensch, M., & Kyritsis, A. P. (1994). Genetics of primary brain tumors: a review. J.Neurooncol. 18(1): 69-81.
Bondy ML, Scheurer ME, Malmer B, Barnholtz-Sloan JS, Davis FG, Il'yasova D, et al. (2008). Brain tumor epidemiology: consensus from the Brain Tumor Epidemiology Consortium. Cancer.113 (7 Suppl):1953-68.
CBTRUS Statistical Report: Primary Brain and Central Nervous System Tumors Diagnosed in the United States in 2004-2005 www.cbtrus.org.
Chang SM, Parney IF, Huang W, Anderson FA, Jr., Asher AL, Bernstein M, et al. (2005). Patterns of care for adults with newly diagnosed malignant glioma. JAMA. 293: 557-64.
Fleury A, Menegoz F, Grosclaude P, Daures JP, Henry-Amar M, Raverdy N, et al.(1997). Descriptive epidemiology of cerebral gliomas in France. Cancer. 79:1195-202.
Fuentes R; Marcos-Gragera R; Vilardell L, Villa-Freixa S; Perez-Bueno Ferrán (2010). Population Based Epidemiology of Central Nervous System (CNS) malignancies in the Girona province (Spain). Results of an 11 years survey (1994-2004) J Neuroncol., en prensa..
Guomundsson KR(1970). A survey of tumors of the central nervous system in Iceland during the 10-year period 1954-1963. Acta Neurol Scand. 46: 538-52.
Helseth A, Langmark F, Mork SJ (1988). Neoplasms of the central nervous system in Norway. II. Descriptive epidemiology of intracranial neoplasms 1955-1984. APMIS. 96:1066-74.
Helseth A, Mork SJ (1989). Neoplasms of the central nervous system in Norway. III. Epidemiological characteristics of intracranial gliomas according to histology. APMIS. 97: 547-55.
Joensen P (1981). Incidence of primary intracranial neoplasms in an isolated population (the Faroese) during the period 1962-1975. Acta Neurol Scand.64:74-8.
Kallio M (1988). The incidence of intracranial gliomas in southern Finland. Acta Neurol Scand. 78: 480-3.
Louis D, Ohgaki H, Wiestler O, Cavanee (2007). W. WHO Classification of Tumours of the Central Nervous System. 4th ed. Lyon.
Martinez Garcia C, Sánchez Pérez MJ, Peris Bonet R. Epidemiologia. En: Arraez M.A., Herruzo I, Acha T, Benavides M. Tumores del SNC en el adulto y en la infancia. Enfoque multidisciplinario Neuro-oncológico. Madrid: Nova Sidonia Oncologia y hematologia, 2003, 3-11.
National Cancer Institute. Surveillance Epidemiology and End Results (SEER). http://seer.cancer.gov/
Preston-Martin S, Mack W (1996). Neoplasms of the nervous system. In: Schottenfeld D and Fraumeni JF (Eds). Cancer Epidemiology and Prevention. Second Edition. New York: Osford University Press. pp 1231-1281.
Schlehofer, B., Blettner, M., Preston-Martin, S., Niehoff, D., Wahrendorf, J., Arslan, A., Ahlbom, A., Choi, W. N., Giles, G. G., Howe, G. R., Little, J., Menegoz, F., & Ryan, P. (1999). Role of medical history in brain tumour development. Results from the international adult brain tumour study. Int. J. Cancer. 82: 155-160.
Survival of Cancer Patients in Europe.EUROCARE-4. www.eurocare.it
Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ, et al.(2005) Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med Mar 10;352(10):987-96.
Vredenburgh JJ, Desjardins A, Herndon JE, Dowell JM, Reardon DA, Quinn JA, et al.(2007) Phase II trial of bevacizumab and irinotecan in recurrent malignant glioma. Clin Cancer Res Feb 15;13(4):1253-9.
Westphal M, Hilt DC, Bortey E, Delavault P, Olivares R, Warnke PC, et al. (2003) A phase 3 trial of local chemotherapy with biodegradable carmustine (BCNU) wafers (Gliadel wafers) in patients with primary malignant glioma. Neuro Oncol Apr;5(2):79-88.
- 20472 lecturas