PARKINSONISMO Y DEMENCIA: UN CASO CLÍNICO-PATOLÓGICO
Fecha publicación:
21-02-2012Autor:
Maria Jose Gil MorenoDescripción:
MOTIVO DE LA CONSULTA:
Mujer de 58 años que acude para reevaluación de síndrome parkinsoniano.
ANTECEDENTES:
- No alergias a fármacos conocidas.
- Hipertensión arterial de largo tiempo de evolución.
- Ansiedad.
- Intervenciones quirúrgicas: Cirugía de nódulo tiroideo, tabique nasal, histerectomía con prolapso uterino miomatoso, nefrectomía radical derecha por hipernefroma.
- No antecedentes familiares de interés neurológico (tío Enfermedad de Alzheimer).
- Maestra (finaliza diplomatura con 21 años).
Tratamientos farmacológicos:
Losartán/hidroclorotiazida, Alprazolam, Citalompram, Pramipexol, L-DOPA, Memantina, Oxprenolol.
ENFERMEDAD ACTUAL:
Se trata de una mujer de 58 años que presenta un cuadro de torpeza generalizada, lentitud y temblor postural en miembros superiores de dos años de evolución. Inicialmente es diagnosticada de Enfermedad de Parkinson idiopática. Se inicia tratamiento con Pramipexol y L-Dopa con beneficio terapéutico.
Dos años después del inicio del cuadro parkinsoniano es reevaluada por presentar de forma fluctuante: conducta impulsiva, cambios de carácter con violencia y agresividad, ataques de llanto repentino y comportamiento infantil. Presenta asimismo dificultades en concentración, poca capacidad de comprensión y razonamiento y dificultad para hablar y expresarse. En ocasiones confunde ideas simples, también nombres de objetos y personas. Comienza a perder las rutinas de su vida diaria, mantiene poca relación con el entorno y muestra falta de cuidado personal.
En la exploración neurológica se objetiva: clara alteración en prueba de secuencias alternantes y en patrones motores alternantes unilaterales (triple maniobra de Luria), lenguaje muy pobre con carencia de sustantivos y confusiones frecuentes, desorientación parcial en tiempo y espacio, movimientos extraoculares pobres (aunque sin limitación) junto rigidez y bradicinesia generalizadas.
Un año después del inicio de los síntomas conductuales presenta empeoramiento progresivo de las funciones cognitivas siendo dependiente para realizar actividades instrumentales y requiriendo ayuda para actividades básicas. También presenta despertares nocturnos frecuentes. Mantiene tratamiento con L-DOPA con mejoría de las funciones motoras.
En este momento se objetiva mediante la exploración neurológica: deterioro global de funciones cognitivas con torpeza en pruebas alternantes frontales. Reflejo palmo-mentoniano positivo y reflejo de parpadeo alterado. Hipomimia facial, rigidez axial y en extremidades, bradicinesia global y pérdida de movimientos asociados durante la marcha. Por disfagia, precisa colocación de sonda nasogastrica para su alimentación (30 días antes de su fallecimiento).
Meses después de la última evaluación, aproximadamente 4 años después del inicio de los síntomas parkinsonianos, la paciente fallece siendo su sistema nervioso central donado para investigación.
PRUEBAS COMPLEMENTARIAS:
RMN cráneo e hipófisis:
- Lesiones inespecíficas, posiblemente isquémicas crónicas, en sustancia blanca periventricular y núcleos basales. Masa paraselar anterior compatible con meningioma.
- Atrofia corticosubcortical.
- Arteriopatía de pequeño vaso.
- Meningioma supraselar con introducción parcial a silla turca.
Analítica: Bioquímica básica sin alteraciones, salvo urea 58 y calcio 11.1. Colesterol 158, triglicéridos 137. Hierro y ferritina sin alteraciones. Vitamina B12 y ácido fólico normales. Hemograma y coagulación sin alteraciones.
Anatomía Patológica:
Estudio macroscópico:
Destaca una moderada disminución del volumen de hemisferio izquierdo y discreta atrofia cortical macroscópica. En tronco cerebral se aprecia intensa despigmentación de sustancia nigra. Destaca ateromatosis sin estenosis en vasos del polígono de Willis. No se observa atrofia del lóbulo temporal.
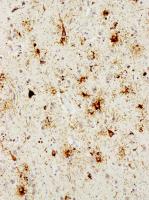
Estudio microscópico (se realizan tinciones específicas con hematoxilina-eosina, inmunotinción tau, β-amiloide, ubiquitina y α-sinucleína):
Pérdida neuronal y gliosis a nivel cortical (fronto-temporal), hipocampo y giro dentado y ganglios basales. La inmunotinción para proteína tau es positiva en córtex fronto-temporal (astrocitos en penacho, coiled bodies y ovillos neurofibrilares), hipocampo y giro dentado, núcleo caudado, putamen y pálido, mesencéfalo (sustancia nigra) y cerebelo (núcleo dentado). La inmunotinción para proteínas β-amiloide y α-sinucleína resultaron negativas.
FIGURA 1. INCLUSIONES TAU (+): Astrocitos en penacho “tufted astrocytes”, inclusiones oligodendrogliales “coiled bodies”.
FIGURA 2. SUSTANCIA NIGRA COMPACTA: Comparación caso (izquierda) – control (derecha). Intensa pérdida neuronal, ovillos globoides y hebras tau positivas.
Despliega el Juicio Clínico para ver el diagnóstico
Presentamos un caso clínico de una mujer de 58 años con un síndrome parkinsoniano al que dos años después se añaden síntomas cognitivos y conductuales.
Inicialmente la paciente presenta un cuadro de lentitud y torpeza generalizadas, con signos en la exploración sugerentes de síndrome parkinsoniano. De hecho, la paciente es diagnosticada de Enfermedad de Parkinson Idiopática y se inicia tratamiento dopaminérgico con mejoría de los síntomas motores. En contra de este diagnóstico podríamos destacar la presencia de temblor simétrico fino distal, en cambio, apoyaría el diagnóstico la mejoría sintomática con tratamiento.
Dos años después presenta un cuadro caracterizado por cambios de carácter y afectación cognitiva, con torpeza en pruebas alternantes frontales y alteración de reflejos de liberación frontal que evoluciona a una demencia de características frontotemporales.
La parálisis supranuclear progresiva es una enfermedad degenerativa del sistema nervioso central de curso progresivo descrita en 1964.1 Se caracteriza por alteraciones posturales, con caídas frecuentes, parkinsonismo rígido-acinético de predominio axial, alteración oculomotora y parálisis pseudobulbar. 2,3
Los criterios diagnósticos son sensibles pero poco específicos. Los más utilizados son los propuestos por el National Institute of Neurological Disorders and Stroke y Society for Progressive Supranuclear Palsy (NINDS-SPSP). 4
Desde el punto de vista anatomo-patológico 3,5,6 los hallazgos característicos de la PSP son:
- Estudio macroscópico: atrofia mesencéfalo, pedúnculo cerebeloso superior, protuberancia, globo pálido y núcleos subtalámicos. Despigmentación sustancia nigra, locus coeruleus y núcleo dentado del cerebelo.
- Estudio microscópico: inclusiones de proteína tau en astrocitos (astrocitos “en penacho”) y en oligodendrocitos (“cuerpos espirales”) localizados en ganglios de la base, diencéfalo, mesencéfalo y regiones perirrolándicas. Existen ovillos neurofibrilares con apariencia globosa.
Se han descrito formas atípicas en la Parálisis Supranuclear Progresiva, inicialmente descritas “formas frustradas” por Steele, Richardson y Olszewski 1. Lantos en 1994 describe tres tipos de PSP, según la distribución de patología neurofibrilar 7. En 2005, Williams describe dos variantes, la forma parkinsoniana que responde a L-DOPA (PSP-P) y la forma de aquinesia pura y fallo de la marcha (PSP-PAGF) 8. Posteriormente Williams describe dos tipos de variantes: corticales y de tronco cerebral, según la distribución de patología tau 9.
La variante cortical puede presentarse en forma de demencia frontotemporal, degeneración corticobasal, afasia progresiva no fluente y esclerosis lateral primaria y se caracteriza por la presencia de patología tau en áreas corticales. En la variante de tronco cerebral se engloba el parkinsonismo con respuesta a L-Dopa y la forma aquinesia pura y fallo de la marcha, con patología tau en globo pálido, diencéfalo y tronco cerebral 9,10.
Existe por tanto una forma de Parálisis Supranuclear Progresiva que puede presentarse con síntomas similares a una Demencia Frontotemporal y que presenta un sustrato patológico de acúmulo de proteína tau en áreas corticales y otras áreas típicas de PSP.
Diversos estudios de presentación frontal en PSP afirman que la variante conductual suele ser la forma más frecuente y que el inicio del diagnóstico suele ser a edad más temprana y con síntomas motores de inicio 11,12.
La parálisis supranuclear progresiva es la taupatía 4R más frecuente 6 . Existe una gran heterogenicidad clínica dentro de las taupatías; con relativa frecuencia existen síndromes “solapados” 10, con características clínicas y patológicas similares, como el caso que presentamos. Es importante el uso de criterios clínicos que deben ser utilizados como guía para el diagnóstico de estas entidades y confirmar con el examen patológico la sospecha clínica.
BIBLIOGRAFÍA:
1. Steele J.C.; Richardson J.C.; Olszewski J. Progressive supranuclear palsy. A heterogeneous degeneration involving the brain stem, basal ganglia and cerebellum with vertical gaze and pseudobulbar palsy, nuchal dystonia and dementia. Archives of Neurology 1964; 10: 333-359.
2. Rampello L.; Buttà V.; Raffaele R.; Vecchio I.; Battaglia G.; Cormaci G, et al. Progressive supranuclear palsy: a systematic review. Neurobiologic Diseases 2005; 20:179-186.
3. Carnero Pardo C. Parálisis supranuclear progresiva. En: Guía oficial para la práctica clínica en demencias: conceptos, criterios y recomendaciones 2009. Grupo de Estudio de Neurología de la Conducta y Demencias. Sociedad Española de Neurología. Barcelona. Editorial: Prous Science, S.A.U. 2009.p.143-154.
4. Litvan I.; Agid Y.; Calnde D.; Campbell G.; Dubois B.; Duvoisin R.C., et al. Clinical research criteria for the diagnosis of progressive supranuclear palsy (Steele-Richardson-Olszewski syndrome): report of the NINDS-SPSP international workshop. Neurology 1996; 47: 1-9.
5. Dickson D.W.; Rademakers R.; Hutton M.L. Progressive supranuclear palsy: pathology and genetics. Brain Pathology 2007; 17: 74-82.
6. Cains N.J.; Bigio E.H.; Mackencie I.R.; Neumann M.; Lee Y.; Hatanpaa K.J.; With III C.; Schneider J.A.; Tenenholz Grinberg L.; Halliday G.; Duyckaerts C.; Lowe J.S. Neuropathologic diagnostic and nosologic criteria for frontotemporal lobar degeneration: consensus of the Consortium for Frontotemporal Lobar Degeneration. Acta Neuropathology 2007 July; 114 (1): 5-22.
7. Lantos PL. The neuropathology of progressive supranuclear palsy. J Neural Transm 1994; 42:137-152.
8. Williams D.R.; de Silva R.; Paviour D.C, et al. Characteristics of two distinct clinical phenotypes in pathologically proven progressive supranuclear palsy: Richardson´s syndrome and PSP-parkinsonism. Brain 2005; 128:1247-1258.
9. Williams D.R.; Lees A. Progressive supranuclear palsy: clinicopathological concepts and diagnostic challenges. Lancet Neurology 2009; 8: 270-279.
10. Dickson D.W.; Ahmed Z.; Algom A.A.; Tsuboi Y.; Josephs K.A. Neuropathology of variants of progressive supranuclear palsy. Current Opinion Neurology 2010; 23: 304-400.
11. Kaat D.L; Boon A.J.; Kamphorst W.; Duivenvoorden H.J.; van Swieten J.C. Frontal presentation in progressive supranuclear palsy. Neurology 2007; 69: 723-729.
12. Bibio E.H; Brown D.F.; White III C. Progressive supranuclear palsy with Dementia: Cortical Pahology. Journal of Neuropathology and Experimental Neurology 1999; 58: 359-364.
Puntuación
Este neurocaso ha tenido: 29173 lecturas
- Maria Jose Gil Moreno's blog
- Inicie sesión para enviar comentarios
- 29173 lecturas